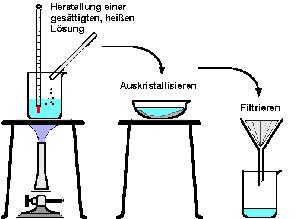

Zur Reinigung von Feststoffen loest man sie haeufig in einem geeigneten Loesemittel oder Loesemittelgemisch auf, filtriert zur Entfernung der Verunreinigung und kristallisiert wieder aus. Dazu nutzt man entweder die Temperaturabhaengigkeit der Loeslichkeit eines Stoffes aus oder seine unterschiedliche Loeslichkeit in verschiedenen Loesemitteln.
Das Prinzip dieser Methode ist recht einfach: man stellt im siedenden Loesemittel, das mit dem zu reinigenden Stoff nicht reagieren darf, eine gesaettigte (heissgesaettigte) Loesung her, filtriert die Verunreinigung ab und laesst die Loesung abkuehlen. Durch die geringe Loeslichkeit der meisten Verbindungen bei niedrigen Temperaturen kristallisieren sie jetzt aus. Man waehlt das Loesemittel fuer eine Umkristallisation deshalb auch unter dem Gesichtspunkt aus, dass es in der Kaelte sehr wenig, am Siedepunkt aber sehr viel von dem zu reinigenden Stoff loest. Von der Loeslichkeit bei Raumtemperatur haengt es auch ab, wieviel des geloesten Stoffes zurueckgewonnen wird. Das wird allerdings auch davon bestimmt, welche Loesemittelmenge man eingesetzt hat. Um sie moeglichst klein zu halten, bieten sich - wenn man kein Loeslichkeitsdiagramm zur Verfuegung hat - zwei Moeglichkeiten:
1. Man wiegt 1 g der Substanz ab und setzt ihr in einem Reagenzglas so lange portionsweise Loesemittel zu, bis sie in der Siedehitze vollstaendig in Loesung gegangen ist. Die notwendige Loesemittelmenge rechnet man auf die Gesamtstoffportion um.
2. Man legt bei thermisch stabilen Substanzen etwas vom Loesemittel in einem mit Rueckflusskuehler versehenen Rundkolben vor, gibt die gesamte Substanzportion zu, erhitzt unter Ruehren zum Sieden und fuellt dann so lange Loesemittel durch den Kuehler nach, bis die Substanz vollstaendig geloest ist.
Die Verunreinigungen, besonders kolloidal geloeste Stoffe, koennen durch Zusatz von Adsorptionsmitteln (z.B. Tierkohle, Kieselgur, Bleich- oder Fullererde, Aluminiumoxid) besser abgetrennt werden. Zur Vermeidung eines Siedeverzuges muessen die Loesungen vor Zugabe des Adsorptionsmittels unter die Siedetemperatur abgekuehlt werden. Da Adsorptionsmittel auch einen Teil des zu reinigenden Stoffes adsorbieren, werden sie nur in geringen Mengen zugesetzt.
Zur Filtration verwendet man Nutschen und Trichter mit weitem, moeglichst verkuerztem Ablaufrohr, damit sie nicht durch schon auskristallisierende Substanzen verstopft werden. Bei besonders problematischen Umkristallisationen ist es ratsam, die Trichter vorzuwaermen bzw. sich heizbarer Trichter oder Nutschen zu bedienen.
Durch die Abkuehlgeschwindigkeit der filtrierten Loesung kann man die Groesse der entstehenden Kristalle regulieren. Kuehlt die Loesung schnell ab, dann bleiben die Kristalle klein und lassen sich schlecht filtrieren. Beim langsamen Abkuehlen werden die Kristalle gross und es besteht die Moeglichkeit, dass Loesemittel eingeschlossen wird.
Die gereinigten Kristalle werden vom Loesemittel abgetrennt und getrocknet. Den Reinheitsgrad kontrolliert man durch die Bestimmung des Schmelzpunktes. Es wird so oft umkristallisiert, bis er konstant bleibt. Aus der Mutterlauge laesst sich durch Eindampfen des Loesemittels weitere Substanz gewinnen.
Im Unterschied zur physikalischen Methode des Umkristallisierens aus heissgesaettigter Loesung ist das Umfaellen ein chemischer Vorgang. Er beruht darauf, dass sich Verbindungen in Saeuren und Laugen unterschiedlich loesen. So wird die in Wasser schwerloesliche Benzoesaeure mit NaOH versetzt. Das entstandene Natriumsalz ist loeslich, Verunreinigungen bleiben nach der Filtration im Filter zurueck. Zur gereinigten Loesung des Salzes gibt man Salzsaeure, wodurch sich die schwerloesliche Saeure zurueckbildet und auskristallisiert. Sie wird abfiltriert und getrocknet.
Wenn eine Substanz aus der Loesung auch nach laengerem Stehen im Eisbad nicht auskristallisiert, greift man zu einer der folgenden Methoden:
1. Man kratzt mit einem Glasstab an den Waenden des Gefaesses, um Kristallisationskeime zu bilden.
2. (Impfkristall) Man gibt einen kleinen Kristall der zu reinigenden Verbindung in die Loesung.
3. Man gibt ein zweites Loesemittel zu, das zwar mit dem ersten mischbar ist, in dem sich aber die Substanz schlecht loest. Setzt man z. B. einer alkoholischen Loesung Wasser zu, dann faellt der in Wasser unloesliche Stoff aus.
4. (Aussalzen) Man fuegt der waessrigen Loesung Salz zu, das die geloeste Substanz verdraengt. Dieses Verfahren wird haeufig bei der Herstellung von Farbstoffen genutzt. (www.experimentalchemie.de)