Man stellt eine molare Loesung her, z.Bsp. 1 Molloesung, indem man 1 Mol einer Verbindung in einem Liters des Loesungsmittels loest. 1 Mol einer Loesung ist das Gewicht in Gramm des Molekulargewichtes, d.h. wenn das Molekulargewicht (die Summe der einzelnen Molekulargewichte der einzelnen Atome des Molekuels) z.Bsp. 40.01 fuer NaOH in Gramm in einen Liter Loesungsmittel loest. (eigen)
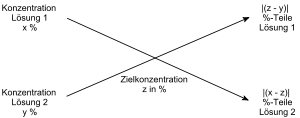
Zur Herstellung einer x-%igen Loesungs eines Mittels aus 2 n-%igen Loesungen verwendet man die Kreuzregel. Als erstes werden der Prozentgehalt der Loesung, die man konzentrierter hat, oben links angegeben. Dann wird der Prozentgehalt der schwaecheren Loesung unten links angegeben. Dann wird in die Mitte die gewuenschte Konzentration eingegeben. Dann verlaengert man von unten links nach oben rechts und von unten rechts nach obenlinks die Pfeile ueber die Mitte hinweg und erhaelt so ein Kreuz mit den gegebenen und gewuenschten Konzentrationen. Jetzt muss man oben rechts die Differenz von untenlinks und der Mitte berechnen. Jetzt muss man noch unten die Differenz von obenlinks und der Mitte berechnen. So erhaelt man die Mengen der benoetigen Mengen an nieder- und hoeher konzentrierter Loesung. (eigen)