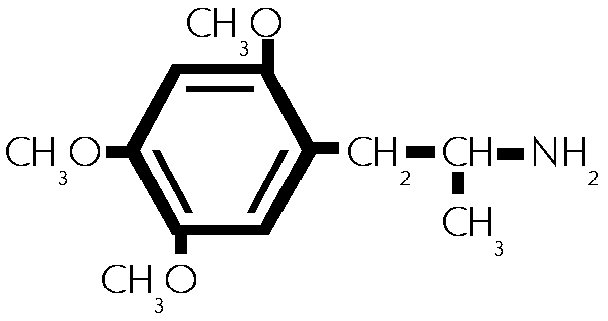

(#42)
2,4,5-Trimethoxyamphetamin. (#42)
A. Shulgin gibt in seinem Buch PIHKAL folgende Kommentare zur Wirksamkeit dieser Substanz:
Es gab absolut keinen Grund zu vermuten, dass die einfache Umordnung der Methoxygruppen von TMA aus der klassischen 3,4,5-Position zu dieser neuen 2,4,5-Orientierung die Potenz dramatisch steigern wuerde. Meskalin (3,4,5-Trimethoxyphenethylamin) ist eine aussergewoehnliche Verbindung, aber es ist nicht besonders potent. Es werden hunderte mg fuer einen Trip benoetigt. Der Wechsel von seinem 3,4,5-Muster zum 2,4,5-Muster von TMPEA macht die Verbindung auch weniger potent. Es gab eigentlich keine Berichte in der wissenschaftlichen Literatur ueber die zentrale Aktivitaet von 2,4,5-substituierten Stoffen. Damit konnte es keine logische Vorbereitung auf die Aktivitaet von TMA-2 geben. Meine sehr fruehen Versuche waren mit 400mcg. Die Dosen, die untersucht wurden, wurden in huebsch grossen Schritten erhoeht, meistens an getrennten Tagen. Am November 26, 1962, als 12mg als inaktiv getestet wurden, wurden andere 12mg 1h spaeter eingenommen. Dies war das 24mg Entdeckungsexperiment, wovon oben ein Stueck zitiert wurde.
Die unerwartete zehnfache Steigerung der Wirksamkeit, entdeckt durch die einfache Umgruppierung von einer einfachen Methoxygruppe von TMA, gab dem weiteren Jonglieren von Methoxygruppen eine sehr hohe Prioritaet. Es gibt insgesamt 6 moegliche Anordnungen fuer die 3 Gruppen, naemlich, 3,4,5- (das originale TMA), 2,4,5- (das gegenwaertige TMA-2), und dann in systematischer Folge, 2,3,4-, 2,3,5-, 2,3,6-, und 2,4,6. Diese Verbindungen waren zu dieser Zeit unbekannt. Ihnen hatte man die Namen TMA-3, TMA-4, TMA-5 und TMA-6 in dieser Reihenfolge zugeordnet. Shulgin machte sie alle.
Nachdem man die Perle der 2,4,5-Position gefunden hatte, ist es lehrreich zur Natur zurueckzuschauen, um zu sehen, was das Pflanzenaequivalent sein koennte. Es gibt in der Tat einige wenige aetherische Oele, die ihre Methoxygruppen in dieser Anordnung haben. TMA-2 ist so eines von den 'Aetherischen' Amphetaminen. Das natuerliche Skelett wird bei den "Asaron-en" gefunden, mit alpha-Asaron als trans-propenyl, beta-Asaron als cis-propenyl und gamma-Asaron (auch Euasaron genannt) als Allyl-Isomer.
Studien ueber die optischen Isomere wurden bis zu 6 mg von jedem der separaten Isomere gemacht, wurden aber niemals hoeher dosiert. Das 'R' Isomer ist sehr viel potenter in Untersuchungen am Hasen, aber die Relation zum Menschen ist zur Zeit unbekannt. Ebenso wurde eine Studie mit dem 14C markierten Racemat (5 microcuries in 40mg) druchgefuehrt mit einen Blick auf die Metabolitenanalyse, aber wieder wurde das Projekt verlassen, bevor irgendein Ergebnis erhalten wurde. In der Ratte erschien das 4-Methoxykohlenstoffatom als ausgeatmetes Kohlenstoffdioxid mit einem Gehalt von rund 20%. Das ist in etwa vier mal die Menge, wie von den beiden anderen zwei Methoxykohlenstoffatomen. (#42)
Es existieren folgende Wirkungsberichte, die von A. Shulgin in seinem Werk "PIHKAL" veroeffentlicht worden sind:
24mg: Ich nahm die Dosis in 2 Haelften, 1h getrennt. Anfaenglich war mir ein wenig uebel, mit leichtem Zittern und maessiger Pupillenerweiterung. Aber nach 1h gab es das ganze Paket von Meskalin, nur die intensive Farbintensivierung fehlte. Die Welt ist gefuellt mit verzerrten, bewegten Dingen. Dann wurde meine kleinen Finger an beiden Haenden periodisch taub. Und es gab gelegentlich Benommenheit. Die 2 Phaenomene wechselten sich ab, und kamen sich niemals in den Weg. Beides verging, nachdem ich erkannte, dass ich mich von dieser Erfahrung erholen wuerde. Dann kamen der Humor und die Freude an der Welt zurueck. Das Nachlassen der Wirkung war ausgesprochen schnell von der 5.- bis 8.-ten Stunde. Es blieben keine Wirkungen nach der zwoelften Stunde zurueck.
40mg: Sehr langsames Herunterkommen. Ich fuehlte es fuer eine Stunde nicht, aber dann ein volles +++ in noch einer Stunde. Schoene Erfahrung. Erotik ausgezeichnet. Bilder mit geschlossenen Augen und Phantasien zur Musik. Keine dunklen Ecken. Guetig und friedlich und lieblich. Es gab kurze Darmkraempfe am Anfang, und ein wenig Durchfall, aber keine anderen Probleme. Ich war nach 8h in der Lage zu schlafen, aber ich hatte gedaempfte Traeume.
40mg: Schoenes +++. Einiges Visuelles, aber nicht aufdringlich. Maessige, manierliche, kaleidoskopische Bilder gegen Dunkles. Musik ausgezeichnet. Klares Denken. Kosmisch ruhig. Dies ist eine fruchtbare oder archetypische, zentralwirksame Droge. Eine sehr gute Erfahrung und gut fuer Wiederholungen. Rund 10-12h. Schlaf schwierig, aber OK. (#42)
Der Dosisbereich von TMA-2 ist nach A. Shulgin im Bereich von 20-40mg. (#42)
Die Dauer der Wirkung wird von A. Shulgin mit 8-12h angegeben. (#42)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Der bekannte amerik. Drogendesigner und Drogenforscher A. Shulgin gibt folgendes Herstellungsverfahren von dem Halluzinogen TMA-2 an:
Zu einer Loesung von 50g 2,4,5-Trimethoxybenzaldehyd in 175ml Nitroethan wurden 10g wasserfreies Ammoniumacetat zugesetzt. Die Mischung wurde am Dampfbad 2h lang erhitzt. Das ueberschuessige Nitroethan wurde im Vakuum entfernt. Der tief orange, oelige Rest wurde in ein Becherglas gegossen. Der Kolben wurde mit 3x60ml kochendem MeOH gewaschen. Beim Ruehren der vereinten Dekantationen und Waschungen gab es eine spontane Bildung von Kristallen. Nach dem Abkuehlen wurden diese durch Filtration entfernt, sparsam mit MeOH gewaschen, und an der Luft bis zu einem konstantem Gewicht getrocknet, was 35.1g 2-Nitro-1- (2,4,5-trimethoxyphenyl) propen, als gelbe Kristalle mit einem mp von 98-99 Grad Celsius, ergab. Umkristallisieren aus MeOH steigerte den mp auf 101-102 Grad Celsius.
Eine Suspension von 31.6g gepulverten LAH in 1l wasserfreien THF, die ein wenig wasserfreien Et2O beinhaltete, wurde zu sanftem Kochen am Rueckfluss gebracht. Dann wurde eine Loesung von 40g 2-Nitro-1- (2,4,5-trimethoxyphenyl) propen in 200ml wasserfreiem THF 4h lang hinzugefuegt. Die Mischung wurde 24h lang am Kochen am Rueckfluss gehalten. Dann wurde auf 0 Grad Celsius mit aeusserlichem Eis gekuehlt. Das ueberschuessige Hydrid wurde zerstoert durch die Addition, in Folge, von 32ml H2O (welche mit ein wenig THF verduennt worden sind), 32ml 15%-iger NaOH, und schliesslich mit 96ml H2O. Die weissen, anorganischen Feststoffe wurden durch Filtration entfernt. Der Filterkuchen wurde mit THF gewaschen. Die vereinten Filtrate und Waschungen wurden vom Loesungsmittel im Vakuum befreit, um 48g unreines bernsteinfarbenes Oel zu ergeben. Das Oel wurde in 180ml IPA geloest und mit 30ml konz. HCl neutralisiert. Die Mischung wurde mit 1,5l wasserfreiem Et2O verduennt. Nach einer kurzen Ausloesungszeit entstand ein oeliger Niederschlag, der sich beim Ruehren in eine lockere, kristalline Phase veraenderte. Diese wurde durch Filtration entfernt, mit Et2O gewaschen, und an der Luft getrocknet, um 29g TMA-2-HCl, als feine, weisse Kristalle mit einem mp von 188.5-189.5 Grad Celsius, an Ausbeute zu ergeben. Anal. (C12H20ClNO3) C,H,N.
Ein 4g Beispiel der freien Base wurde in 15ml Pyridin geloest, mit 2.5ml Essigsaeureanhydrid versetzt, am Dampfbad 20 Min. lang erhitzt, zu 400ml H2O zugefuegt, mit HCl angesaeuert, und mit 3x75ml CH2Cl2 extrahiert. Nach dem Waschen mit H2O wurden die vereinten Extrakte vom Loesungsmittel im Vakuum getrennt, um 4.5g blaetterige, gebrochen weisse Feststoffe zu ergeben, die nach dem Umkristallisieren aus MeOH weiss waren, 2.3g wogen, und einen mp von 132-133 Grad Celsius hatten. Umkristallisieren von diesem Acetamid aus MEK verbesserte seine Qualitaet nicht. Anal. (C14H21NO4) C,H,N. (#42)
1933: TMA-2 wurde erstmalig synthetisiert. (49/290)
1962: Die psychoaktive Wirkung der Verbindung wurde entdeckt. A. Shulgin erhielt das Halluzinogen durch Aminisierung von Asaron aus dem Kalmusoel (aus Acorus calamus). (49/290)
2006: Die Droge wird unter das Einheitsuebereinkommen (single convention) der UN gestellt. Damit ist sie beinahe weltweit verboten. (#134)
Abbildung 1: In: TRACHSEL Daniel, RICHARD Nicolas: "Psychedelische Chemie.", S. 351, Nachtschatten Verlag, Solothurn, 2000.