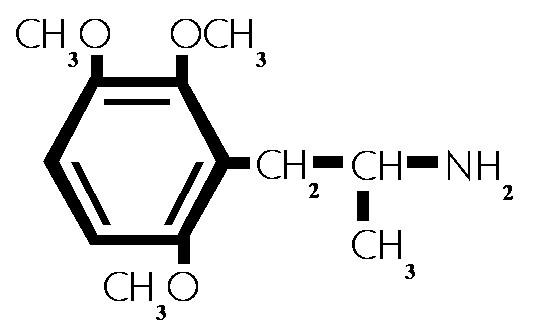

(#42)
2,3,6-Trimethoxyamphetamin. (#42)
TMA-5 ist ein halluzinogenes Amphetamin, wie auch die anderen Verbindungen mit dem Praefix TMA in dieser Information. TMA ist die Stammsubstanz dieser Reihe von Verbindungen, doch TMA ist auch mit vielen anderen halluzinogenen Amphetaminen verwandt, beispielsweise DOM (STP), DOB, DOC,... Die einzelnen TMA-Verbindungen unterscheiden sich durch die Lage ihrer Methoxygruppen. (eigen)
Als die halluzinogene Wirksamkeit der Verbindung TMA festgestellt wurde, und es weiters festgestellt wurde, dass TMA merklich wirksamer als das Meskalin sei, untersuchte A. Shulgin positionelle Isomere dieser Rauschdroge und erstellte die 6 moeglichen TMA-Abkoemmlinge. (#42)
A. T. Shulgin fuehrt in PIHKAL weiters aus, dass TMA-5 nur oberflaechlich untersucht wurde. (#42)
A. Shulgin gibt jene sehr kurzen und etwas duerftigen Wirkberichte in seinem Buch "PIHKAL" an:
20mg: Es schien ein leichte Stimulation zu geben. Es gab eine bescheidene Pupillenerweiterung, aber normalen Puls. Wenn dies die Grenzecke der Vergiftung ist, ist es kein Halluzinogen, sondern ein Aufputschmittel. Hoehergehen mit der Dosis muss mit Vorsicht geschehen.
30mg: Intensive Introspektion. Vergleichbar mit rund 75 mcg LSD, oder mehr. (#42)
30mg oder mehr, vermutet A. Shulgin. (#42)
Die Wirkdauer der Verbindung betraegt 8-10h nach A. Shulgins Werk "PIHKAL". (#42)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
A. Shulgin gibt ein Herstellungsverfahren von TMA-5 in seinem Buch "PIHKAL" an:
Eine Loesung von 100g 1,2,4-Trimethoxybenzol in 1l Hexan wurde auf 15 Grad Celsius abgekuehlt und mit 400ml einer 15%-igen Loesung von n-Butyllithium in Hexan versetzt. Ein weisser Niederschlag bildete sich sofort. Ruehren wurde fuer weitere 2h fortgesetzt, waehrend die Reaktion auf Raumtemperatur zurueckkehrte. Es wurde dann eine Loesung von 40g frisch destilliertem Propionaldehyd in 100ml Hexan hinzugefuegt. Die Reaktion war exotherm. Als das Ruehren fortgesetzt wurde, loeste sich der Niederschlag stufenweise. Das Ruehren wurde uebernacht bei Raumtemperatur fortgesetzt. Es wurde dann 1l H2O hinzugefuegt. Die Reaktion wurde mit HCl angesaeuert. Die Hexanphase wurde abgetrennt. Die verbleibende waessrige Phase wurde mit Hexan extrahiert, dann mit Et2O. Die vereinten organischen Extrakte wurden vom Loesungsmittel im Vakuum befreit. Der Rest wurde destilliert, um 60g Ethyl-2,3,6-trimethoxyphenylcarbinol zu ergeben. Von obigen Et2O Extrakten wurde zusaetzliches Carbinol erhalten, dass eine kleine Menge des anfaenglichen 1,2,4-Trimethoxybenzols beinhaltete. Die 2 Substanzen wurden leicht durch Vakuumdestillation getrennt, was zusaetzliche 21g des Carbinols ergab.
Der obige Alkohol, 60g Ethyl-2,3,6-trimethoxyphenylcarbinol, wurde ohne Loesungsmittel geruehrt und auf 0 Grad Celsius mit einem aeusseren Eisbad abgekuehlt. Es wurden dann 80g PBr3 so schnell hinzugefuegt, dass die Temperatur unter 60 Grad Celsius blieb. Am Ende der Addition wurden Mengen von Eisstuecken hinzugefuegt, gefolgt von H2O. Die Reaktionsmischung wurde mit 3x100ml Et2O extrahiert. Entfernen des Loesungsmittels ergab 60g 1-Brom-1-(2,3,6-trimethoxyphenyl)propan, dass im folgenden Dehydrobrominierungsschritt ohne weitere Reinigung gebraucht wurde.
Eine Loesung von 60g 1-Brom-1-(2,3,6-trimethoxyphenyl)propan im gleichen Gewicht EtOH wurde mit 120g KOH Plaetzchen versetzt. Die exotherme Reaktion wurde mit fortgesetzten Ruehren uebernacht sich selbst ueberlassen. Die Mischung wurde dann in H2O geloescht und mit 3x200ml CH2Cl2 extrahiert. Entfernen des Loesungsmittel von den vereinten Extrakten ergab ein rohes Produkt, dass kein anfaengliches Brommaterial beinhaltete, aber mit einer spuerbaren Menge des Ethoxyanalogs, 1-Ethoxy-1-(2,3,6-trimethoxyphenyl)propan, verunreinigt war. Dieses unreine Produkt wurde mit 50%-iger H2SO4 kurz auf 80 Grad Celsius erhitzt. Abkuehlen, Verduennen mit Wasser, und re-Extraktion mit 3x100ml CH2Cl2 ergab, nach Entfernen der fluechtigen Stoffe im Vakuum, 1-(2,3,6-Trimethoxyphenyl)propen. Dies wurde destilliert, um 7g klares Oel zu erhalten, dass ein 12:1 Verhaeltnis des trans- und cis-Isomers war.
Eine gut geruehrte Loesung von 6.8g der gemischten Isomere von 1-(2,3,6-Trimethoxyphenyl)propen in 40g trockenem Aceton wurde mit 3.2g Pyridin versetzt und auf 0 Grad Celsius mit einem aeusseren Eisbad abgekuehlt. Es wurden dann 6.5g Tetranitromethan hinzugefuegt, verteilt auf 1 Min. Das Ruehren wurde fuer zusaetzliche 2 Min. fortgesetzt. Dann wurde die Reaktion durch die Addition von 2.2g KOH in 40ml H2O abgebrochen. Es wurde zusaetzliches H2O hinzugefuegt. Organisches wurde mit 3x75ml CH2Cl2 extrahiert. Das Loesungmittel der vereinten Extrakte wurde im Vakuum entfernt. Die 5.3g Rest wurden bei 0.2mm/Hg destilliert. Eine Fraktion, die bei 150-170 Grad Celsius siedete, war hauptsaechlich 2,3,6-Trimethoxybenzaldehyd. Eine zweite Fraktion (170-200 Grad Celsius bei 0.2mm/Hg) kristallisierte auch spontan zu einem gelben Feststoff. Dieser wurde aus MeOH umkristallisert, um 2.8g 2-Nitro-1-(2,3,6-Trimethoxyphenyl)propen, mit einen mp von 73-74 Grad Celsius, zu ergeben, nach dem Trocknen zu konstantem Gewicht.
Zu einer am Rueckfluss befindlichen und geruehrten Suspension von 2.4g LAH in 300ml wasserfreiem Et2O, unter einer Inertatmosphaere, wurde eine Loesung von 2.4g 2-Nitro-1-(2,3,6-trimethoxyphenyl)propen in 100ml wasserfreiem Et2O hinzugefuegt. Die Mischung wurde 4h lang am Rueckfluss gehalten und dann gekuehlt. Das ueberschuessige Hydrid wurde vorsichtig durch die Addition von 1.5N H2SO4 zerstoert. Es wurden dann 40g Kalumnatriumtartrat hinzugefuegt, gefolgt von genuegend waessriger NaOH, um den pH-Wert auf groesser 9 zu heben. Die Et2O Phase wurde abgetrennt. Die verbleibende waessrige Phase wurde mit 3x100ml CH2Cl2 extrahiert. Die organische Phase und die Extrakte wurden vereint. Das Loesungsmittel wurde im Vakuum entfernt. Es ergab 1.8g farbloses Oel. Dieses wurde in 200ml wasserfreiem Et2O geloest, der mit wasserfreiem HCl Gas gesaettigt war. Es wurde ein dickes Oel gebildet, dass langsam kristallisierte. Der resultierende weisse, kristalline Feststoff wurde durch Filtration entfernt. Es ergab 2.2g TMA-5-HCl. Der mp war 124-125 Grad Celsius. Anal. (C12H20ClNO3) C,H. (#42)