
(#101/434)
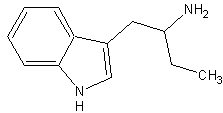
Etryptamin, (#57, 101/433) alpha-ET; alpha-Ethyltryptamine; Indole, 3-(2-aminobutyl); Tryptamine, alpha-ethyl; 3-(2-Aminobutyl)indole; Monase; (#101/433) 1-(1H-indol-3-yl)butan-2-amine; (Wikipedia)
150 mg. (#23)
Diese Verbindung ist von der chemischen Struktur betrachtet ein typisches Tryptamin. Es damit verwandt mit einer Reihe anderer Halluzinogene, aber auch mehr physisch wirksamer Drogen. Es ist natuerlich auch nahe mit dem gehirneigenen Neurotransmitter Serotonin (5-Hydroxytryptamin) verwandt, welcher eine wesentliche Rolle im Gehirn des Menschen spielt. (eigen)
Diese Rauschdroge ist ein MAO (Monoaminoxidase-) Hemmer, der von der Wirkung gleich stark ist, wie die antidepressive Leitdroge Iproniazid. Etryptamin wurde in den 50'er Jahren auch als medizinischer MAO-Hemmer (als Antidepressiva) medizinisch verwendet. (#57) Entwickelt wurde er von der Upjohn chemical company in den Vereinigten Staaten. (Wikipedia)
Diese Rauschdroge ist MAO (Monoaminoxidase-) Hemmer, der von der Wirkung gleich stark ist, wie die antidepressive Leitdroge Iproniazid. (#57) Es wirkt eher wie MDMA - eher als ein Halluzinogen oder Entheogen. (Wikipedia)
Summenformel: C12H16N2; Mol. masse: 188.27 g/mol; Schmelzpunkt: 222-223 Grad Celsius; (Wikipedia)
100 - 150 mg, oral. (#101/434)
6 - 8 h. (#101/434)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Zu einer 50 Grad Celsius warmen Mischung von 60 mL Eisessigsaeure und 18 mL Essigsaeureanhydrid wurde 66 g kristallines Ammoniumacetat hinzugefuegt und das Ruehren wurde fortgesetzt bis die Loesung komplett war (20 Min.). Zu diesem wurde hinzugefuegt eine Loesung von 87 g Indol-3-carboxaldehyd und 300 mL Nitropropan in 360 mL Essigsaeure. Die Mischung wurde auf Rueckflusstemperatur 3 h lang gehalten, abgekuehlt, und verduennt mit 360 mL H2O. Nach dem Stehen bei 10 Grad Celsius fuer etliche zusaetzliche Stunden, wurden die Feststofe durch Filtration etnfernt und umkristallisiert aus 600 mL 40%-igem EtOH, um nach Filtration und Lufttrocknen zu einem konstantem Gewicht 44.5 g 1-(3-Indolyl)-2-nitrobuten-1 (alpha-Ethyl-beta-indoleninideniumethylnitronat) mit einem Schmelzpunkt von 128-131 Grad Celsius zu ergeben.
Eine Suspension von 31.7 g LAH in 300 mL wasserfreiem THF, geruehrt unter einer Inertatmosphaere, wurde durch die Addition von einer Loesung von 36 g 1-(3-Indolyl)-2-nitrobut-1-en in 285 mL wasserfreiem THF versetzt. Dies wurde tropfenweise hinzugefuegt verteilt auf die Dauer von 3h, waehrend die Mischung zum Kochen am Rueckfluss gebracht wurde. Die Reaktionsmischung wurde am Kochen am Rueckfluss fuer zusaetzliche 2 h gehalten, dann wurde es erlaubt auf Zimmmertemperatur zurueckzukehren. Nach dem Stehen ueber Nacht, wurde das ueberschuessige Hydrid zerstoert durch die vorsichtige Addition von 500 mL nassem Et2O, gefolgt von 70 mL H2O, 100 mL THF, und schliesslich 20 mL 50%-iger NaOH. Nach 1 h zusaetzlichen Ruehren wurden die Feststoffe durch Filtration entfernt, mit 1.5 L Et2O gewaschen, die vereinten Filtrate und Waschungen getrocknet ueber wasserfreiem K2CO3, und das Loesungsmittel wurde unter Vakuum entfernt. Der Rest, 78 g, wurde in 100 mL MeOH geloest, mit 12 mL Essigsaeure versetzt, von allen fluechtigen Stoffen unter Vakuum befreit, wiedergeloest in einer Mischung von 250 mL Ethylacetat und 30 mL MeOH, konzentriert auf ein Volumen von rund 100 mL, und wiederum versetzt mit 2 mL Essigsaeure. Das Produkt alpha-Ethyltryptaminacetat (alpha-ET) trennte sich ab als ein Feststoff mit einem Schmelzpunkt von 164-165.5 Grad Celsius. Es kann aus Ethylacetat/MeOH umkrisallisiert werden, welches den Schmelzpunkt auf 165-166 Grad Celsius steigerte. Die freie Base, aus Ethylacetat/Petroleumaether, hatte einen Schmelzpunkt von 97-99 Grad Celsius. Das Hydrochloridsalz hatte einen Schmelzpunkt von 215.5-218 Grad Celsius. Das Pikrat hatte einen Schmelzpunkt von 165-166 Grad Celsius. (#101/433f.)
50'er Jahre: Etryptamin wurde medizinisch als MAO-Hemmer verwendet. (#57)
1980'er: Es wurde als eine Designerdroge missbraucht. (Wikipedia)
1993: Folglich wurde es in den USA verboten, indem man es in Schedule I platzierte. (Wikipedia)