
(#23, #54/135)
THC ist die Abkuerzung fuer Tetrahydrocannabinol; dieser Begriff wird sehr oft als Sammelbegriff fuer die einzelnen Isomere von THC verwendet. Das Wort wird aber auch haeufig als Abkuerzung fuer den Hauptwirkstoff delta1-THC verwendet, der nur ein moegliches Isomer ist. (#27, #62/452)
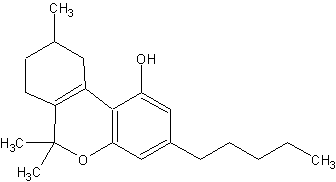
delta6a,10a-THC. (#23, #54/135)
Die halluzinogene Verbindung ist nahe verwandt mit dem Hauptwirkstoff der Hanfpflanze dem sogenannten delta1-THC. Aber delta3-THC ist eine kuenstliche Verbindung. Es ist ein Isomer des natuerlichen delta1-THC's (Tetrahydrocannabinol), von dem es sich durch eine verschobene Doppelbindung unterscheidet. Es ist psychoaktiv wirksam. (#27)
An dieser Stelle soll kurz auf eine Problematik in der Lesbarkeit der chemischen Nomenklatur (Bezeichnungsverfahren) fuer THC hingewiesen werden. Da die Tetrahydrocannabinole komplizierte, heterocyclische Kohlenwasserstoffverbindungen sind, und auch aus historischen Gruenden (die Nomenklaturverfahren haben sich mehrfach geaendert), gibt es verschiedene Nummerierungen der Atome fuer alle Tetrahydrocannabinole, die leider optisch nur schwer zu unterscheiden sind, (#27, #45) und leider sehr haeufig in verschiedenen Publikationen verwechselt werden. (eigen)
Der beruehmte Drogenforscher A. Shulgin publizierte in dem bekannten Sammelwerk Mikuriya T.: "Marijuana: Medical Papers. 1839-1972." eine Arbeit, welche die bekannte chemische Literatur ueber THC zusammenfasste. Der Titel dieses Sammelwerkartikels war: "Recent Developments in Cannabis Chemistry.". In diesem Artikel befindet sich auch ein Exkurs ueber die verschiedenen Nomenklatursysteme (chemische Bennenungssysteme) fuer die Cannabinoide. A. Shulgin schrieb, dass es grundsaetzlich vier verschiedene Systeme der Bennennung gibt:
Dies war das erste benutzte Modell der systematischen Bennenung aus chemischer Sicht, welches verwendet wurde. Der Englaender Todd fuehrte dieses System ein. Die Basis dieses Systems ist, dass man THC als ein substituiertes Pyran auffasst. Folglich ergibt sich folgendes System der Nummerierung: (#61/399)
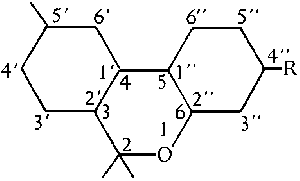 Abb. Das Pyransystem. (#61/399/1)
Abb. Das Pyransystem. (#61/399/1)
Mit dem zuerst benutzten Modell der Pyrannummerierung ist auch dieses System nahe verwandt. Es betrachtet THC als substituiertes Dibenzopyransystem. Dieses Benennungssystem verwendet die Chemical Abstracts (CA) Normen. Beide Systeme, das Pyransystem und das Dibenzopyransystem haben einen entscheidenen Nachteil: Wenn naemlich der zentrale Pyranring bei irgendwelchen Isomeren geoeffnet ist, aendert sich automatisch die Nummerierung. (#61/399f.)
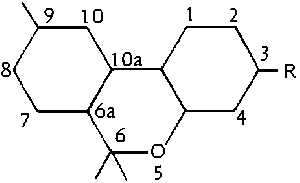 Abb. Das Dibenzopyransystem. (#61/399/2)
Abb. Das Dibenzopyransystem. (#61/399/2)
Um die Nachteile des Pyran- und des Dibenzopyransystems der Nummerierung zu vermeiden wurde hauptsaechlich in Europa ein neues System verwendet, naemlich das Diphenyl-nomenklatursystem. In diesem System ergibt sich nun folgende Nummerierung fuer die einzelnen Atome des THC-Molekuels: (#61/400)
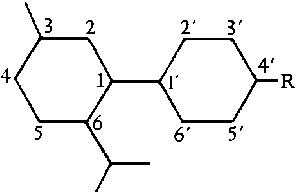 Abb. Das Biphenylsystem. (#61/400/1)
Abb. Das Biphenylsystem. (#61/400/1)
Heutzutage wird am haeufigsten ein System verwendet, welches sowohl den Terpenteil des THC-Molekuels, als auch den aromatischen Teil, in die Betrachtungen einschliesst. Dieses System ist das Terpen-basierende Nomenklatursystem. In diesem System ergeben sich folgende Nummern fuer die einzelnen Atome des THC-Molekuels: (#61/400f.)
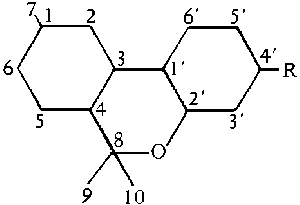
Abb. Das Terpensystem. (#61/400/2)
Nach den bekannten Drogenforschern Richard Evans Schultes und Albert Hofmann, in ihrem bekannten Klassiker der Halluzinogenforschung, dem Werk "Botany and Chemistry of Hallucinogens", werden die THC-Isomere, wenn sie in den Koerper aufgenommen werden, wie auch andere zentralwirksame Drogen abgebaut. Dieser Vorgang wird als Metabolisierung bezeichnet. Die 7-Methylgruppe scheint der prinzipielle Angriffspunkt der Metabolisierung zu sein. 7-Hydroxy-delta1-THC und 7-Hydroxy-delta6-THC werden als erste Abbauprodukte gebildet. (Je nachdem, ob delta1- oder delta6-THC vorliegen.) Diese Reaktion scheint von Wichtigkeit zu sein, denn die 7-OH-Verbindungen zeigten alle eine grosse Aktivitaet in Tierversuchen. Die derzeitige Wissenslage laesst vermuten, dass diese Verbindungen auch fuer die Wirksamkeit im Menschen verantwortlich sind. Die weitere Hydroxylierung der 7-OH-verbindungen bringt nur mehr Deaktivierung. Die endgueltigen Abbauprodukte sind hauptsaechlich saure Verbindungen. (#45/111)
Da delta1-THC und delta6-THC auf diese Weise metabolisiert werden, ist mit hoher Sicherheit anzunehmen, dass diesselben Mechanismen auch auf das wirksame delta3-THC einwirken. So duerfte der Metabolit von delta3-THC 7-Hydroxy-delta3-THC sein. (eigen)
Strukturisomere einer Verbindung haben immer die gleiche Summenformel, d.h. die gleiche Zahl an Atomen pro Molekuel. Strukturisomere unterscheiden sich in den physikalischen und chemischen Eigenschaften und wirken damit auch verschieden auf den Menschen ein. Von einer eher komplexen Verbindung wie THC gibt es natuerlich sehr viele Strukturisomere. An dieser Stelle sollen uns aber nur jene Strukturisomere interessieren, welche sich von der Lage der Doppelbindung im Heterocyclusring (einem 6-er Ring) unterscheiden. Diese Verbindungen werden als Tetrahydrocannabinole bezeichnet - kurz nennt man sie, wie schon oefters erwaehnt, THC´s. Fuer die Strukturisomerie von THC ist der 6-atomige Heterocyclus bedeutsam, denn die Natur selber stellt schon verschiedene Isomere dar, indem die Lage der Doppelbindung in diesem Ring verschoben wird. So kommen natuerlich schon 2 Strukturisomere von THC in der Cannabispflanze vor: delta1-THC und delta6-THC vor. Uebrigens - das delta3-THC - eine kuenstliche Verbindung, war lange Zeit das erste synthetisch herstellbare THC. Es gelang erst viel spaeter die beiden natuerlichen THC´s herzustellen. (eigen)
Die beiden Strukturisomere delta1-THC und delta6-THC unterscheiden sich damit nur durch die Lage der Doppelbindung im 6-Heterocyclus. (#27)
Da die Lage der Doppelbindung im 6-atomigen Heterocyclusring logischerweise 6-fach verschieden liegen kann, gibt es eigentlich 6 moegliche Isomere. Von diesen theoretisch moeglichen THC-Isomeren sind aber nicht alle psychoaktiv. delta5-THC und delta7-THC sind inaktiv. delta3-THC ist, wie schon oben angefuehrt, aktiv. delta1-3,4-cis-THC ist auch inaktiv. (#45/115) Also gibt es 3 wirksame THC-Isomere. Es sind dies delta1-THC, delta3-THC und delta6-THC. (eigen)
| Isomere: | Synonyme: | Psychoaktivitaet: | Formel: |
| delta1-THC | delta9-THC | aktiv | 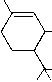 |
| delta1-3,4-cis-THC | inaktiv | ||
| delta3-THC | delta 6a,10a-THC | aktiv | 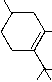 |
| delta5-THC | inaktiv | 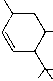 | |
| delta6-THC | delta 1(6)-THC, delta8-THC, delta6-3,4-trans-THC | aktiv |  |
| delta7-THC | inaktiv |
Tabelle. Die 6 moeglichen Strukturisomere von THC.
Nach neueren Forschungsergebnissen wird die Wirkung von Cannabinoiden von den sogenannten Cannabinoidrezeptoren CB1 und CB2 im Gehirn und auch in der Milz des Menschen uebermittelt. Es gibt koerpereigene Stoffe, die sogenannten Anandamide, welche im Koerper des Menschen die Funktion von Cannabinoiden besitzen. Es wurden inzwischen 3 Anandamide nachgewiesen, welche die Wirkungen von Cannabinoiden besitzen. Es sind dies Arachidonylethanolamid, Docosatetraylethanolamid und Homo-Gamma-Linolenylethanolamid. (#100/14f.) Es soll an dieser Stelle an die entsprechenden Beschreibungen der einzelnen Anandamide verwiesen werden.
Die Verbindung delta3-THC soll ein Fuenftel der psychischen Aktivitaet von delta1-THC aufweisen. (#23) Aufgrund der nahen strukturellen Aehnlichkeit mit delta1-THC, dem natuerlichen Wirkstoff der Cannabispflanze, ist auch mit einer aehnlichen Wirkung zu rechen. Die Intensitaet und die Dauer der Wirkung werden sich zwar geringfuegig unterscheiden, doch von der gleichen Qualitaet sein. (eigen)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Es wurde im Journal of the American Chemical Society, 63,1971(1941) cf. Chemical Abstracts, 82,170672-3(1975) eine Synthese fuer delta3-THC beschrieben. (#54/145)
1949: Es wurde eine Synthese von delta3-THC und von THC-Analogen wurde im Journal of the Chemical Society, 952(1949) publiziert. (#54/144f.)
1967: Eine Synthese von delta3-THC und Analogen wurde im Tetrahedron 23, 77(1967) veroeffentlicht. (#23/19, #54/143)
1967: Eine Synthese von delta3-THC und Analogen von Resorcinol aus wurde im Journal Tetrahedron 23, 83(1967) veroeffentlicht. (#23/19, #54/143f.)
11,6g 5-(1,2-Dimethyl)-heptylresorcinol oder die gleiche molare Menge an Olivetol oder einem anderen, aehnlichen Analog, 9,2g 2-Carbethoxy-5-methyl-cyclohexanon (4-Carbethoxy-1-methyl-3-cyclohexanon), 5g POCl3 und 70ml trockenes Benzol (geschuezt vor Feuchtigkeit mit einem CaCl2-Rohr) werden zusammengefuegt. Es wird 5 Min. gekocht und. Es bildet sich HCl. Dann wird das Ganze 20h stehengelassen. Die Loesung wird in 10%-ige NaHCO3-loesung gegossen. Die Benzolschicht wird abgetrennt und mit 3x5oml 10%igem NaHCO3 gewaschen. Das Benzol wird im Vakuum getrocknet und verdampft. Es wird aus 50ml Ethylacetat umkristallisiert, um 6,6g eines Pyrons zu erhalten.
4,5g des Pyrons werden in 150ml Benzol gegeben. Es wird tropfenweise ein Loesung, die aus 7,8g Mg, 18ml Methyliodid und 90ml Aether bereitet wurde, hinzugefuegt. Es wird 20h am Rueckfluss gekocht und dann werden 45ml gesaettigte NH4Cl Loesung hinzugegeben. Die organische Schicht wird abgetrennt und die waessrige Phase wird mit Benzol extrahiert. Die organische Schicht und der Benzolauszug werden vereint und getrocknet. Es wird im Vakuum verdampft, um das THC Analog zu erhalten. (#23/19, #54/143)
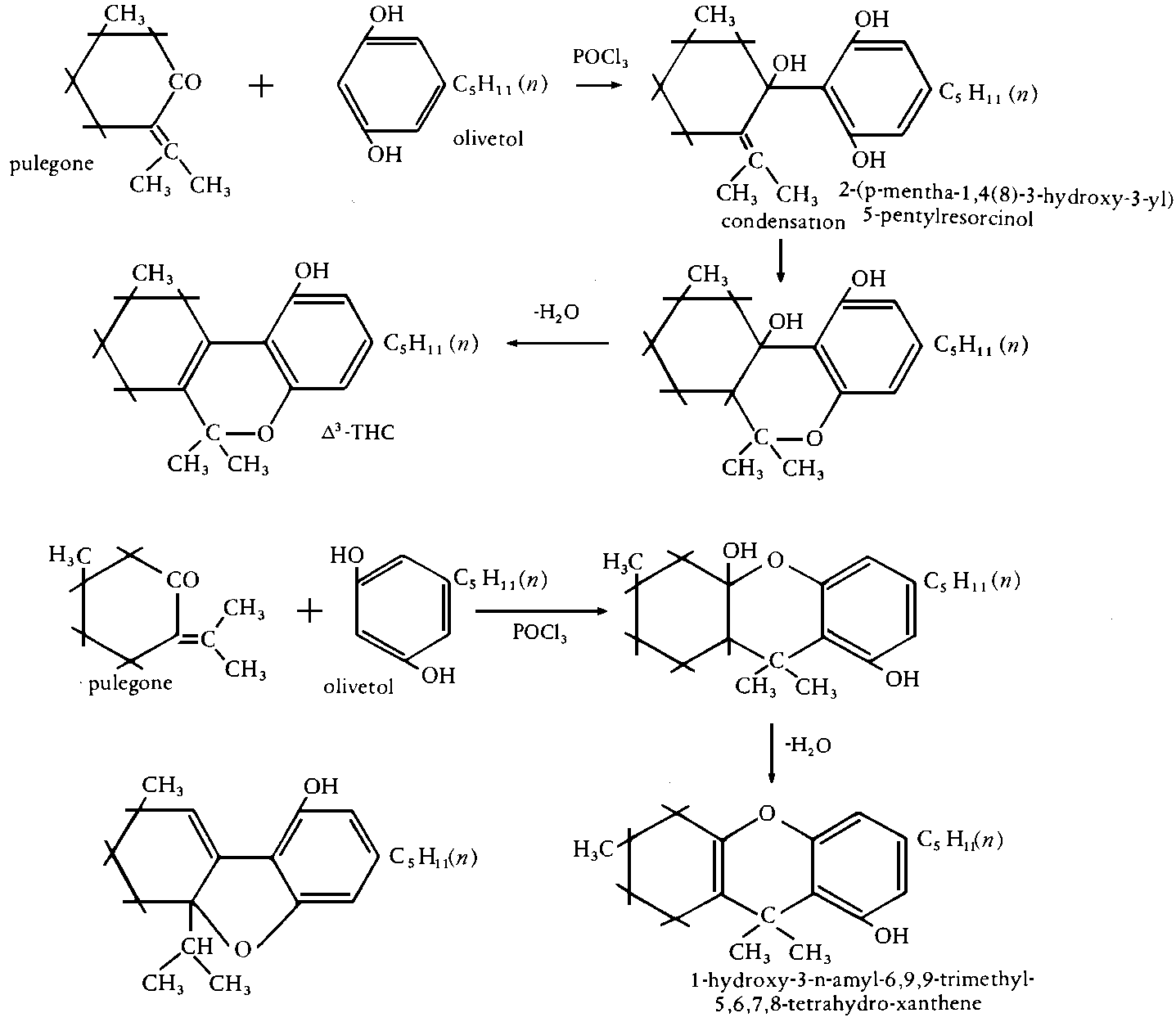 Abb. Synthese von delta3-THC mit den Startsubstanzen Pulegon und Olivetol. Es wird ein moeglicher Reaktionsmechanismus angegeben, ebenso werden potentielle Xanthen-Nebenprodukte mit deren Reaktionsmechanismus, der zu ihrer Erzeugung fuehrt, angegeben. (#61/355)
Abb. Synthese von delta3-THC mit den Startsubstanzen Pulegon und Olivetol. Es wird ein moeglicher Reaktionsmechanismus angegeben, ebenso werden potentielle Xanthen-Nebenprodukte mit deren Reaktionsmechanismus, der zu ihrer Erzeugung fuehrt, angegeben. (#61/355)
7,6g 5-n-Heptyl-Resorcinol oder die gleichmolare Menge eines Analogs, 6,6g (0,037M) 4-Carbethoxy-1-methyl-3-cyclohexanon oder ein Analog und 5,8g POCl3 wurden in 60ml Benzol gegeben. Es wurde 5h am Rueckfluss erhitzt, abgekuehlt und in NaHCO3 gegossen, um rund 6g THC-Analog zu erhalten. 1g mehr kann durch Konzentration der Mutterfluessigkeit erhalten werden. Oder - es kann das unverbrauchte Olivetol zurueckgewonnen werden, wie es woanders beschrieben steht. 3-Carbethoxy-1-methyl-2 oder 4-cyclohexanon, 2-Carbethoxy-cyclohexanon, u.a. ergeben wahrscheinlich auch aktive THC-Analoge. (#54/145)
22g Resorcinol, 20g Polyphosphorsaeure und 36g 4- Carbethoxy -1- methyl -3- cyclohexanonphosphorsaeure werden zusammengefuegt. Es wird auf 105 Grad Celsius erhitzt. Wenn die exotherme Reaktion, die sich ereignet, nachlaesst, dann wird auf 140 Grad Celsius fuer eine halbe Stunde erhitzt. Die Reaktionsloesung wird auf Eiswasser gegossen, filtriert, mit Wasser gewaschen und aus EtOH umkristallisiert, um 34g des Pyrons zu erhalten.
und 8ml Caproyl-Cl oder ein Analog werden zusammengefuegt. Dies wird auf dem Oelbad (ein Mineraloel kann verwendet werden) bei einer Temperatur von 120 Grad Celsius erhitzt, bis die exotherme Reaktion nachlaesst. (HCl-Entwicklung). Es wird abgekuehlt. Die Loesung wird in EtOH gegossen. Es wird filtriert, um 8g Niederschlag zu erhalten.
und 4,4 trockenes Al3 werden zusammengefuegt. Es wird am Oelbad bis 170 Grad Celsius 1h lang erhitzt. Es wird abgekuehlt und HCl hinzugefuegt. Es wird filtriert. Der Niederschlag wird in 7ml 2N NaOH geloest. Es wird filtriert und mit HCl angesaeuert, um 1,4g Niederschlag zu erzeugen. Der Niederschlag wird aus EtOH umkristallisiert. Dieser Niederschlag kann auf Aktivitaet untersucht werden. Man nimmt Benzoyl-Cl oder Benzoesaeureanhydrid, um die OH-Gruppe zu verestern (ist nicht unbedingt noetig), Methyl-MgBr oder Methyl-MgI um die Ketogruppe zu methylieren, und H2SO4 zum Dehydrieren und hydrogenieren, um das THC oder das Analog zu erhalten. Das das resultierende THC-Analog die Seitenkette an der 6´- Position hat, kann es moeglicherweise nicht psychoaktiv sein. Diese Arbeit gibt auch eine Synthese fuer THC-Analoge, welche die Seitenkette an der Position 4´ haben, aber wiederum ist die Pharmakologie beim Menschen unbekannt. Verbenol sollte auch verwendbar sein, "obviating" die Notwendigkeit fuer den Methylierungsschritt. (23/19, 54/143f.)
1,75g 2-Br-4-methyl-benzoesaeure, 1,5 Olivetol oder ein Analog und 10ml 1N NaOH werden bis zum Sieden erhitzt. Es werden 0,5ml CuSO4 hinzugefuegt. Es wird filtriert und mit EtOH gewaschen. Anschliessend wird aus EtOH umkristallisiert, um (I) zu erhalten.
10g (I) werden in 150ml Benzol gegeben. Fuege das Ganze zu Methyl-MgBr, welches aus 47,5g Methyliodid, 8g Mg und 120ml Aether bereitet wurde. Es wird 15 Minuten am Rueckfluss gekocht, abgekuehlt und auf Eis gegossen. Fuege gesaettigte NH4Cl hinzu und trenne den Aether ab. Es wird 2x mit Wasser gewaschen und der Aether wird getrocknet und abgedampft im Vakuum um das THC zu erhalten. (#54/144f.)