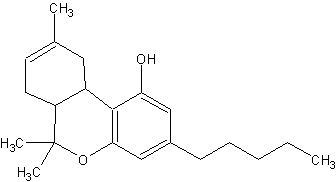

(#27)
THC ist die Abkuerzung fuer Tetrahydrocannabinol; dieser Begriff wird sehr oft als Sammelbegriff fuer die einzelnen Isomere von THC verwendet. Das Wort wird aber auch haeufig als Abkuerzung fuer den Hauptwirkstoff delta1-THC verwendet, der nur ein moegliches Isomer ist. (#27, #62/452)
Aufgrund verschiedener, chemischer Nomenklaturverfahren ergeben sich eine Reihe von verschiedenen Bezeichnungen fuer diese Verbindung:
delta1(6)-THC, delta8-THC, (#23, #27) delta6-3,4-trans-THC. (#23, #62/452)
Summenformel: C21H30O2.
Molekulargewicht: 314,45.
Die Verbindung ist ein Oel, dass einen Siedepunkt von 200 Grad Celsius hat. (#62/452)
Cannabis sativa var. indica (auch C. indica).
Die Verbindung ist von der chemischen Struktur ein Tetrahydrocannabinol. Die einzelnen, natuerlichen Tetrahydrocannabinole, kurz THC´s, unterscheiden sich durch die Lage einer Doppelbindung. Natuerlich kommen delta1-THC und delta6-THC in der Cannabispflanze vor. (#27, #45) In manchen Pflanzen soll ausserdem noch THCV (Propyl-delta1-THC) vorkommen. (#27)
Die Verbindung delta6 ist ebenfalls psychoaktiv. Es steht dem delta1-THC nur um weniges nach. delta6-THC kommt unter natuerlichen Bedingungen nur in Spuren von etwa einem Hunderstel der in einer Haschischprobe vorliegenden delta1-THC-Menge vor. (Das Verhaeltnis von delta1-THC zu delta6-THC in untersuchten Haschischplatten liegt zwischen 99,5:0,5 und 97:3). Bei synthetischen und halbsynthetischen Herstellungsmethoden faellt oft das chemisch stabilere delta6-THC an. (#27)
An dieser Stelle soll kurz auf eine Problematik in der Lesbarkeit der chemischen Nomenklatur (Bezeichnungsverfahren) fuer THC hingewiesen werden. Da die Tetrahydrocannabinole komplizierte, heterocyclische Kohlenwasserstoffverbindungen sind, und auch aus historischen Gruenden (die Nomenklaturverfahren haben sich mehrfach geaendert), gibt es verschiedene Nummerierungen der Atome fuer alle Tetrahydrocannabinole, die leider optisch nur schwer zu unterscheiden sind, (#27, #45) und leider sehr haeufig in verschiedenen Publikationen verwechselt werden. (eigen)
Der beruehmte Drogenforscher A. Shulgin publizierte in dem bekannten Sammelwerk von Mikuriya T.: "Marijuana: Medical Papers. 1839-1972." eine Arbeit, welche die bekannte chemische Literatur zu jener Zeit ueber THC zusammenfasste. Der Titel des Sammelwerkartikels war: "Recent Developments in Cannabis Chemistry.". In diesem Artikel befindet sich auch ein Exkurs ueber die verschiedenen Nomenklatursysteme (chemische Bennenungssysteme) fuer die Tetrahydrocannabinole, der anschliessend - zusammengefasst - wiedergegeben wird. A. Shulgin schrieb in jenen Artikel, dass es grundsaetzlich vier verschiedene Systeme der Bennennung gibt:
Dies war das erste benutzte Modell der systematischen Bennenung aus chemischer Sicht, welches verwendet wurde. Der Englaender Todd fuehrte dieses System ein. Die Basis dieses Systems ist, dass man THC als ein substituiertes Pyran auffasst. Folglich ergibt sich folgendes System der Nummerierung: (#61/399)
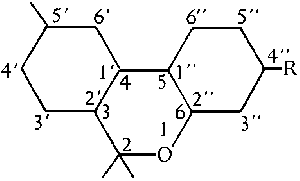 Abb. Das Pyransystem. (#61/399/1)
Abb. Das Pyransystem. (#61/399/1)
Mit dem zuerst benutzten Modell der Pyrannummerierung ist auch dieses System nahe verwandt. Es betrachtet THC als substituiertes Dibenzopyransystem. Dieses Benennungssystem verwendet die Chemical Abstracts (CA) Normen. Beide Systeme, das Pyransystem und das Dibenzopyransystem haben einen entscheidenen Nachteil: Wenn naemlich der zentrale Pyranring bei irgendwelchen Isomeren geoeffnet ist, aendert sich automatisch die Nummerierung. (#61/399f.)
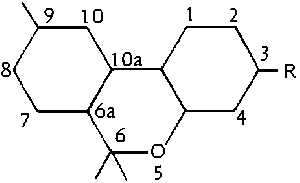 Abb. Das Dibenzopyransystem. (#61/399/2)
Abb. Das Dibenzopyransystem. (#61/399/2)
Um die Nachteile des Pyran- und des Dibenzopyransystems der Nummerierung zu vermeiden wurde hauptsaechlich in Europa ein neues System verwendet, naemlich das Diphenyl-nomenklatursystem. In diesem System ergibt sich nun folgende Nummerierung fuer die einzelnen Atome des THC-Molekuels: (#61/400)
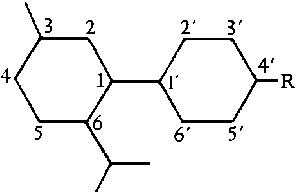 Abb. Das Biphenylsystem. (#61/400/1)
Abb. Das Biphenylsystem. (#61/400/1)
Heutzutage wird am haeufigsten ein System verwendet, welches sowohl den Terpenteil des THC-Molekuels, als auch den aromatischen Teil, in die Betrachtungen einschliesst. Dieses System ist das Terpen-basierende Nomenklatursystem. In diesem System ergeben sich folgende Nummern fuer die einzelnen Atome des THC-Molekuels: (#61/400f.)
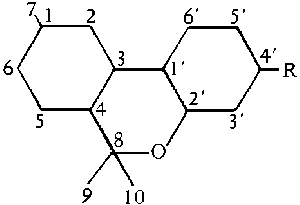 Abb. Das Terpensystem. (#61/400/2)
Abb. Das Terpensystem. (#61/400/2)
Nach den bekannten Drogenforschern Richard Evans Schultes und Albert Hofmann, in ihrem bekannten Klassiker der Halluzinogenforschung, dem Werk "Botany and Chemistry of Hallucinogens", werden die THC-Isomere, wenn sie in den Koerper aufgenommen werden, wie auch andere zentralwirksame Drogen abgebaut. Dieser Vorgang wird als Metabolisierung bezeichnet. Die 7-Methylgruppe scheint der prinzipielle Angriffspunkt der Metabolisierung zu sein. 7-Hydroxy-delta1-THC und 7-Hydroxy-delta6-THC werden als erste Abbauprodukte gebildet. (Je nachdem, ob delta1- oder delta6-THC vorliegen.) Diese Reaktion scheint von Wichtigkeit zu sein, denn die 7-OH-Verbindungen zeigten alle eine grosse Aktivitaet in Tierversuchen. Die derzeitige Wissenslage laesst vermuten, dass diese Verbindungen auch fuer die Wirksamkeit im Menschen verantwortlich sind. Die weitere Hydroxylierung der 7-OH-verbindungen bringt nur mehr Deaktivierung. Die endgueltigen Abbauprodukte sind hauptsaechlich saure Verbindungen. (#45/111)
Strukturisomere einer Verbindung haben immer die gleiche Summenformel, d.h. die gleiche Zahl an Atomen pro Molekuel. Strukturisomere unterscheiden sich in den physikalischen und chemischen Eigenschaften und wirken damit auch verschieden auf den Menschen ein. Von einer eher komplexen Verbindung wie THC gibt es natuerlich sehr viele Strukturisomere. An dieser Stelle sollen uns aber nur jene Strukturisomere interessieren, welche sich von der Lage der Doppelbindung im Heterocyclusring (einem 6-er Ring) unterscheiden. Diese Verbindungen werden als Tetrahydrocannabinole bezeichnet - kurz nennt man sie, wie schon oefters erwaehnt, THC´s. Fuer die Strukturisomerie von THC ist der 6-atomige Heterocyclus bedeutsam, denn die Natur selber stellt schon verschiedene Isomere dar, indem die Lage der Doppelbindung in diesem Ring verschoben wird. So kommen natuerlich schon 2 Strukturisomere von THC in der Cannabispflanze vor: delta1-THC und delta6-THC vor. Uebrigens - das delta3-THC - eine kuenstliche Verbindung, war lange Zeit das erste synthetisch herstellbare THC. Es gelang erst viel spaeter die beiden natuerlichen THC´s herzustellen. (eigen)
Die beiden Strukturisomere delta1-THC und delta6-THC unterscheiden sich damit nur durch die Lage der Doppelbindung im 6-Heterocyclus. (#27)
Daa die Lage der Doppelbindung im 6-atomigen Heterocyclusring logischerweise 6-fach verschieden liegen kann, gibt es eigentlich 6 moegliche Isomere. Von diesen theoretisch moeglichen THC-Isomeren sind aber nicht alle psychoaktiv. delta5-THC und delta7-THC sind inaktiv. delta3-THC ist, wie schon oben angefuehrt, aktiv. delta1-3,4-cis-THC ist auch inaktiv. (#45/115) Also gibt es 3 wirksame THC-Isomere. Es sind dies delta1-THC, delta3-THC und delta6-THC. (eigen)
| Isomere: | Synonyme: | Psychoaktivitaet: | Formel: |
| delta1-THC | delta9-THC | aktiv | 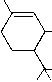 |
| delta1-3,4-cis-THC | inaktiv | ||
| delta3-THC | delta 6a,10a-THC | aktiv | 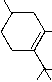 |
| delta5-THC | inaktiv | 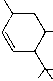 | |
| delta6-THC | delta 1(6)-THC, delta8-THC, delta6-3,4-trans-THC | aktiv | 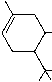 |
| delta7-THC | inaktiv |
Tabelle. Die 6 moeglichen Strukturisomere von THC.
In der lebenden Cannabispflanze liegen die einzelnen Cannabinoide ueberwiegend in ihrer psychisch inaktiven Form vor. Diese Saeureformen koennen durch mehr oder Weniger Waerme und Sauerstoff in die wirksamen decarboxylierten (ohne Saeuregruppe) Formen umgewandelt werden. So wird aus CBDS (Cannabidiolsaeure, auch engl. CBDA) und THCS (THC-Saeure, auch engl. THCA) durch Decarboxylierung beim Trocknen oder Rauchen CBD oder/und THC. (#27, eigen, #41)
Auch die eigentlich kaum psychoaktiven Cannabinoide, wie das CBD (Cannabidiol) oder auch das CBN (Cannabinol) veraendern etwas die Wirkung und bilden zusammen die bekannte Wirkung der Rauschdrogen Marihuana und Cannabis, denn erst die Mischung der einzelnen psychoaktiven Inhaltsstoffe gibt den typischen "turn" einer Cannabisbereitung. Es kommen uebrigens auch Alkaloide in der Pflanze vor, doch diese sind nur in Spuren vorhanden und erzeugen kaum nennenswerte Wirkungen. (#27)
Da das natuerliche delta1-THC selber instabil ist und bei Luftzutritt langsam zerfaellt, altern Marihuana und Haschisch und verlieren mit der Zeit ihre Wirksamkeit. Das Abbauprodukt von THC scheint die Verbindung CBN (Cannabinol) zu sein, welches sich in altem Grass und Haschisch anreichert. (#27)
Die Biosynthese der Cannabinoide, also das genaue chemische Verfahren, nachdem die Pflanzenzellen THC erzeugen, ist nicht sicher erforscht. Allgemein geht man von folgendem Schema aus:
Geranylphosphat (eine in der Pflanzenwelt verbreitete Vorstufe von Terpenen) und Olivetol/Olivetolsaeure kondensieren zu Cannabigerolsaeure. R. Mechoulam, der Entwickler der ersten Synthese von THC, meint, dass dann eine Oxydation zu Hydroxycannabigerol erfolgt, aus dem ueber eine weitere Zwischenstufe (b) Cannabidiol (CBD) bzw. Cannabidiolsaeure (CBDS) cyclisiert wird. (Cyclisierung in der Chemie meint, dass sich eine Kohlenstoffkette zu einem Ring schliesst.). Aus dem entstandenen CBD/CBDS kann wiederum delta9-THC bzw. THCS entstehen. (#27/41)
Die Verbindung CBD spielt noch in einem anderen Zusammenhang eine Rolle. Unwirksame Faser- und Oelhanfsorten bilden ueberwiegend nur CBD, die letzte Vorstufe zum delta1-THC. Der letzte Schritt, eine Umisomerisierung, wird nicht durchgefuehrt. Hier greifen eine Reihe von Verfahren ein, die halbsynthetisch aus CBD durch Umisomerisierung delta1-THC, aber auch das stabilere delta6-THC bilden. (#27)
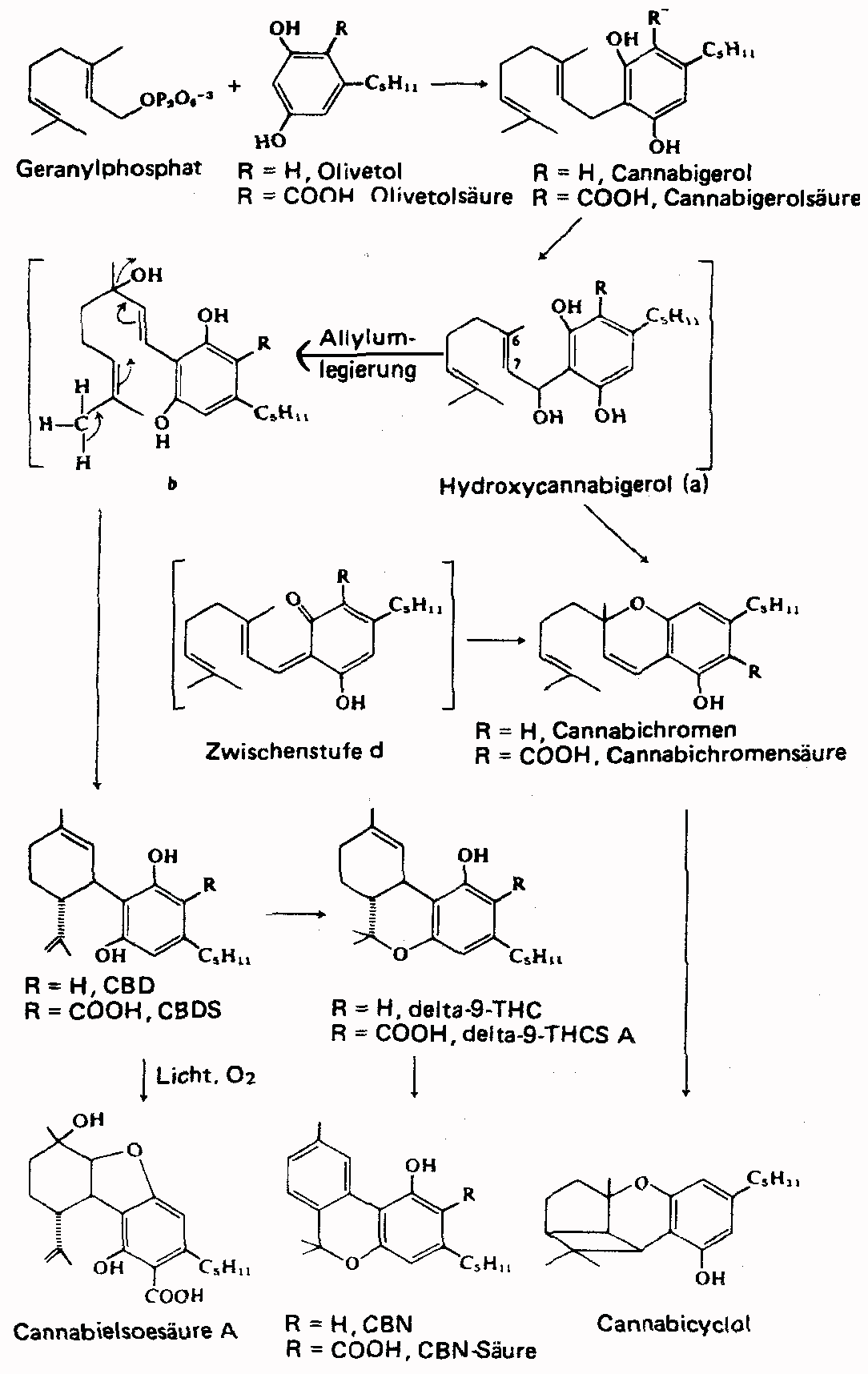 Abb. Vermutliche Biosynthese der Cannabinoide.
Abb. Vermutliche Biosynthese der Cannabinoide.
Nach neueren Forschungsergebnissen wird die Wirkung von Cannabinoiden von den sogenannten Cannabinoidrezeptoren CB1 und CB2 im Gehirn und auch in der Milz des Menschen uebermittelt. Es gibt koerpereigene Stoffe, die sogenannten Anandamide, welche im Koerper des Menschen die Funktion von Cannabinoiden besitzen. Es wurden inzwischen 3 Anandamide nachgewiesen, welche die Wirkungen von Cannabinoiden besitzen. Es sind dies Arachidonylethanolamid, Docosatetraylethanolamid und Homo-Gamma-Linolenylethanolamid. (#100/14f.) Es soll an dieser Stelle an die entsprechenden Beschreibungen der einzelnen Anandamide verwiesen werden.
Es wirkt gleich stark wie delta1-THC. (#23) An dieser Stelle soll auf die Wirkungsbeschreibung von delta1-THC verwiesen werden, denn dieses wirkt qualitativ gleich. (eigen)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Die Verbindung delta6-THC ist stabiler als die natuerlich hauptsaechlich vorkommende Variante delta1-THC. Moderne Synthesen produzieren deshalb hauptsaechlich delta6-THC. (#27)
Alte Synthesemethoden haben uebrigens noch racemisches (+/-)-THC ergeben, doch diese alten Verfahren wurden durch neuere ersetzt, die nur noch das wirksamere (-)-THC ergeben. (#27)
Dieses Verfahren wurde erstmalig von Fahrenholtz, Lurie und Kienstead beschrieben. Es zeichnet sich dadurch aus, dass beide Isomere - delta1- und delta6-THC gebildet werden. Die beiden Isomere koennen nach der Reaktion mittels Chromatographie getrennt werden. Nachteilig bei dieser Synthese ist, dass die endgueltige Ausbeute an THC nur sehr gering ist, jedoch ist die Stereokonfiguration bei dieser Reaktion richtig. (#61/410)
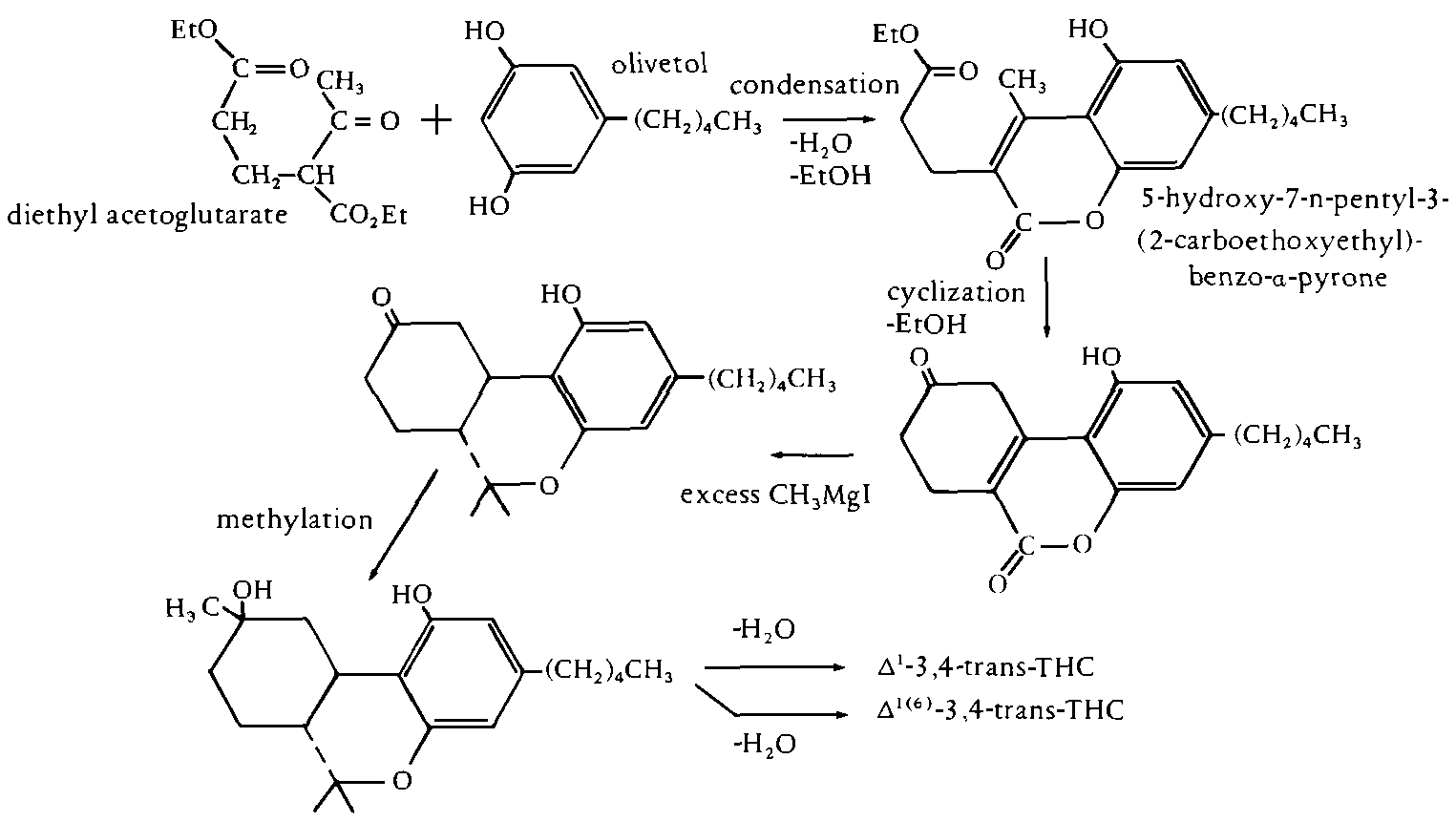 Abb. Synthese von delta1- und delta6 TJC von Diethylacetogluatarat und Olivetol aus der Loesung.
Abb. Synthese von delta1- und delta6 TJC von Diethylacetogluatarat und Olivetol aus der Loesung.
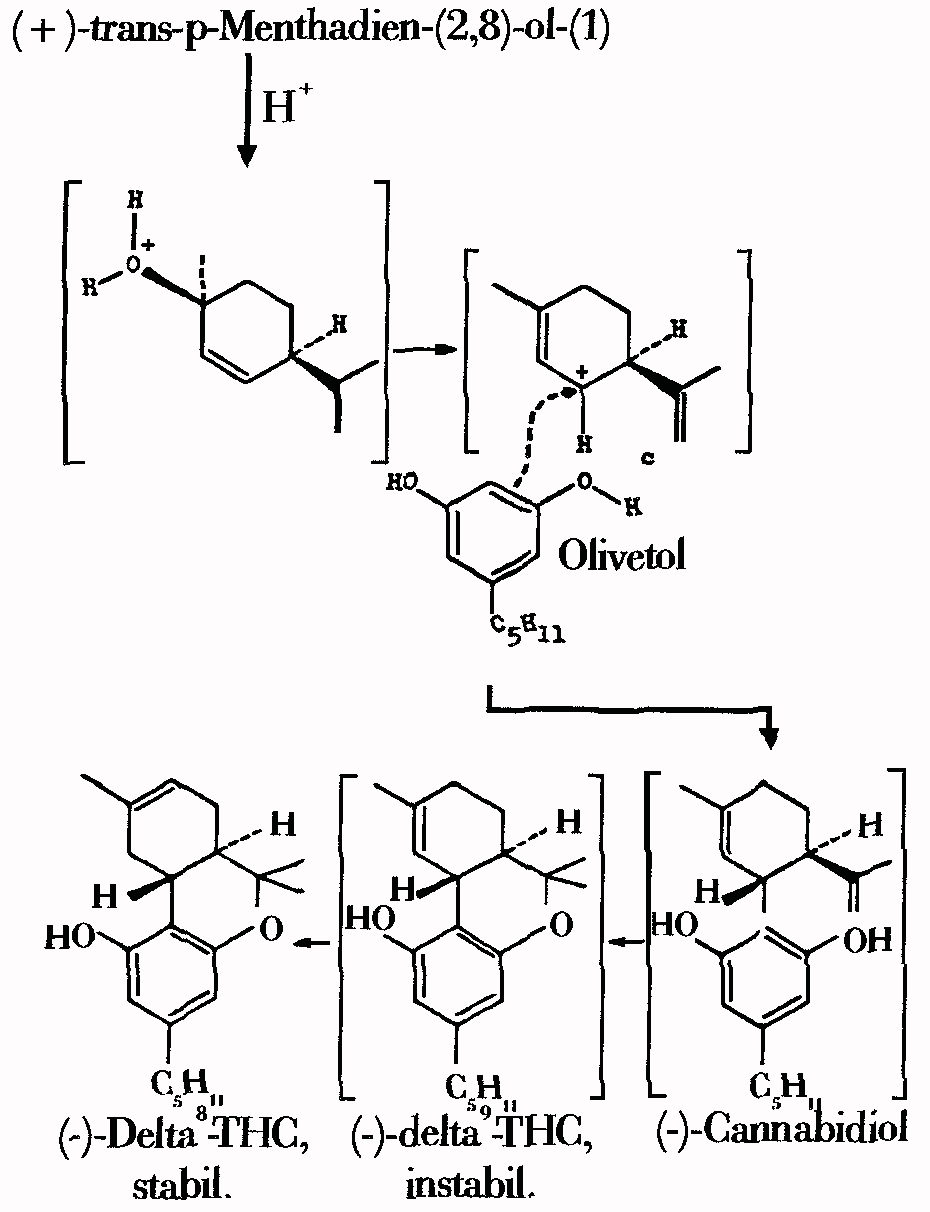
Abb. Reaktionsmechanismus der delta6-THC-Synthese aus (+)-trans-p-Menthadien-(2,8)-ol-(1) und Olivetol mittels starker Saeuren (saeurekatalysierte Kondensationsreaktion).
Diese Methode ergibt eine 50%-ige Ausbeute fuer delta6-THC und eine 90%-ige fuer das 1",1"-Dimethylpentyl-Derivat von THC:
4.74g Olivetol (oder die gleichmolare Menge eines Analogs), 4,03g (+)-cis oder trans-p-Menthadien(2,8)-ol-1 (die razematische Verbindung kann auch genutzt werden, aber die Ausbeute betraegt dann nur die Haelfte) und 0,8g p-Toluolsulfonsaeure werden in 250ml Benzol gegeben. Es wird 2h (oder man verwendet 0,004M Trifluoressigsaeure anstelle der p-Toluolsulfonsaeure und kocht 5h am Rueckfluss.) lang am Rueckfluss gekocht. Es wird abgekuehlt, Aether hinzugefuegt, mit NaHCO3 gewaschen und dann wird getrocknet und unter Vakuum verdampft, um rund 9g einer Mischung (Diese kann auf 350g Silicagel mit Benzol chromatographiert werden. Es loest das THC. Die anschliessende Verwendung von Benzol und Aether im Verhaeltnis 98:2 loesen ein unwirksames Produkt. Dann wird Benzol und Aether im Verhaeltnis 1:1 verwendet. Dies loest das unverbrauchte Olivetol. Es wird unter Vakuum verdampft, um das Olivetol zurueckzugewinnen.) (#23/15)
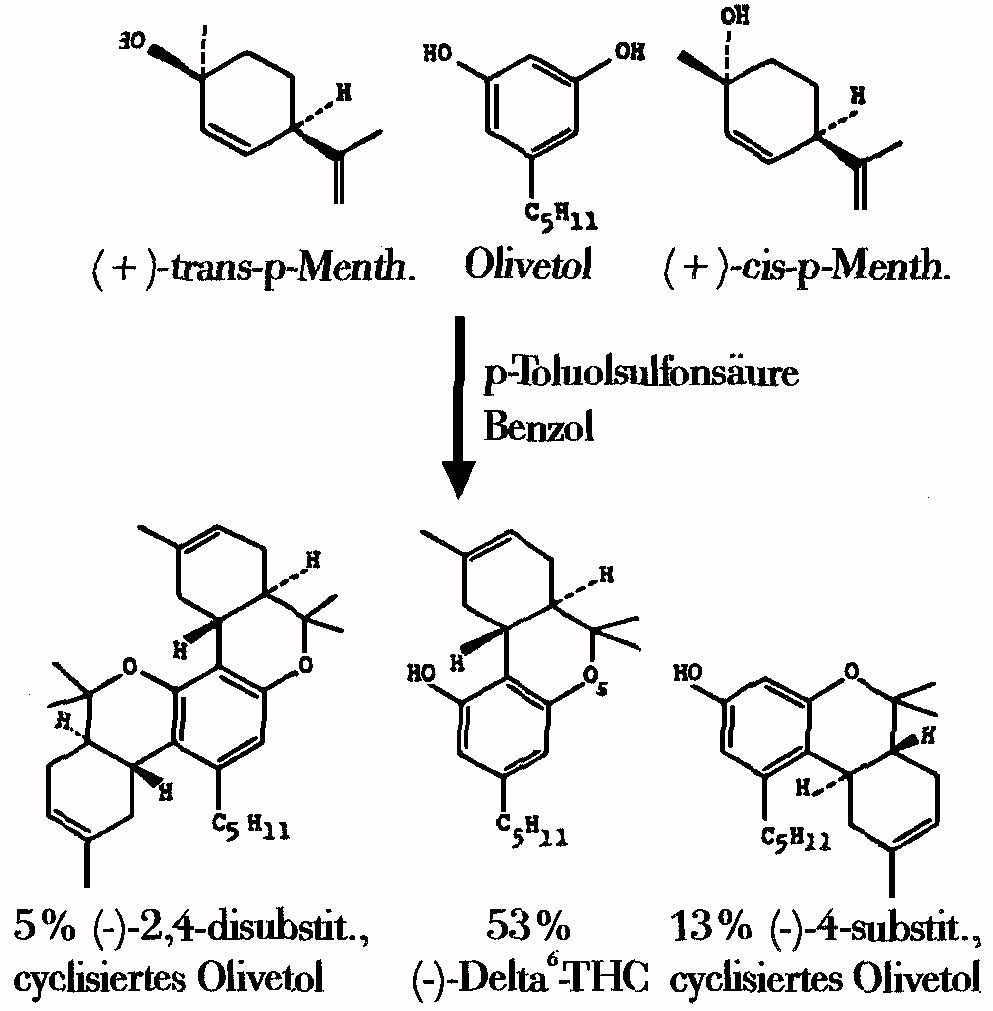 Abb. Reaktionsgleichung der Synthese von delta6-THC aus (+)-trans/cis-p-Menthadien-(2,8)-ol-(1) und Olivetol mittels p-Toloulsulfonsaeure (saeurekatalysierte Kondensationsreaktion) einschliesslich der Nebenprodukte.
Abb. Reaktionsgleichung der Synthese von delta6-THC aus (+)-trans/cis-p-Menthadien-(2,8)-ol-(1) und Olivetol mittels p-Toloulsulfonsaeure (saeurekatalysierte Kondensationsreaktion) einschliesslich der Nebenprodukte.
Dieses Verfahren wurde von Petrzilka, W. Haeflinger und C. Silkemeier in der Helvetica Chimica Acta, Vol. 53, Fasc. 4 (1969) auf den Seiten 1102-1134 publiziert.
Loese 0,36g Olivetol oder ein Analog und 0,27g (+/-)-p-Menthatrien(1,5,8) in 7ml fluessigem SO2. Das Ganze wird in einem Schmelzrohr eingeschmolzen und 24h lang bei Raumtemperatur stehen gelassen. Das Loesungsmittel wird anschliessend unter Feuchtigkeitsausschluss verdampft. Der oelige Rueckstand wird in Aether aufgenommen und in der ueblichen Weise weiter gereinigt. (#27/175)
0,427g Olivetol wurden mit 0,356g (+)-trans-p-Menthadien-(2,8)-ol-(1) in 8ml fluessigem SO2 eingeschmolzen und 70h bei Raumtemperatur stehengelassen. Bei diesem Verfahren entstanden 742ml Rueckstand. Dieser wurde in Aether geloest und in der ueblichen Art und Weise gereinigt. Der Rueckstand wurde mittels 25g Silicagel chromatographiert (1.Benzol; 2. Benzol/Aether 98:2, Benzol/Aether 1:1). (#27/175)
Dieses Syntheseverfahren wurde zuerst von Mechoulam, Braun und Gaoni beschrieben. Vorteil bei dieser Reaktion ist, dass eine der Startverbindungen fuer die Reaktion, alpha-Pinen, kaeuflich erworben werden kann und somit nicht arbeits- und zeit- und kostenintensiv selbst bereitet werden muss. Grundsaetzlich funktioniert die Reaktion nach folgenden Reaktionsschema. Zuerst wird das Pinen zu einem Allylalkohol (Verbinol) oxidiert. Anschliessend wird in einer zweiten Reaktion dieses Verbinol mit Olivetol zusammenkondensiert, was eine Menge von Nebenprodukten und das gewuenschte Olivetyl-pinen ergibt. Dieses muss mittels chromatographischer Verfahren abgetrennt werden. Das Olivetyl-pinen kann in das delta6-THC umgewandelt werden und auch bei Bedarf weiter in das natuerliche delta1-THC isomerisiert werden. Ein weiterer Vorteil bei dieser Methode ist, dass die Stereospezifitaet und die absolute, optische Konfiguration kontrolliert werden, aber wiederum beschraenken die notwendigen chromatographischen Trennungen die Endprodukte auf eine kleine Menge: (#61/410f.)
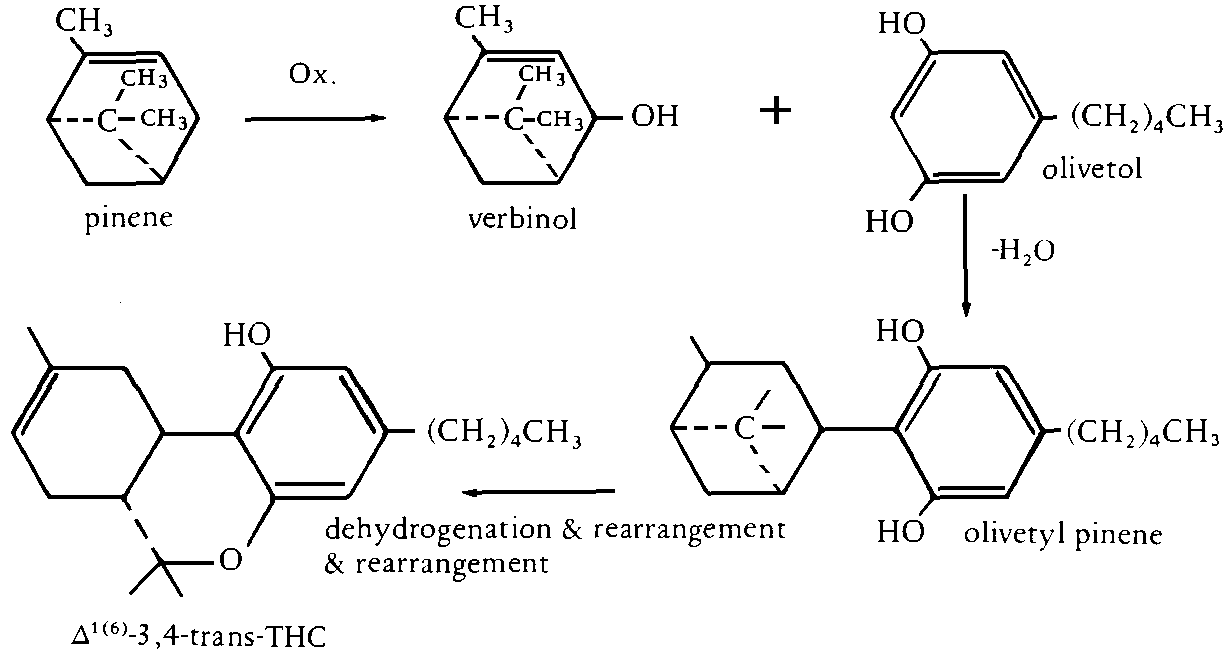 Abb. Synthese von delta1- und delta6-THC von Pinen via Verbinol und Olivetol aus.
Abb. Synthese von delta1- und delta6-THC von Pinen via Verbinol und Olivetol aus.
Ueberfuehre (-)-alpha-Pinen zu (-)-Verbenol (Dies ist die Vorbereitungsreaktion).
Fuege 1M (-)-Verbenol (razematisches Verbenol gibt die Haelfte an Ausbeute), 1M Olivetol oder ein Analog mit Methylenchlorid als Loesungsmittel zusammen. Es wird dann BF3-aetherat hinzugefuegt und alles wird 1,5h bei Raumtemperatur stehengelassen, um annaehernd 35% Ausbeute zu bekommen, nach Verdunsten im Vakuum oder einer Reinigung wie oben, um das unverbrauchte Olivetol zurueckzugewinnen. Es koennen entweder cis- oder trans-Verbenol benutzt werden.
Die JCS-Unterlagen fuegen 1g BF3-aetherat zu einer Loesung von 1g Olivetol und 1,1g Verbenol in 200ml Methylenchlorid und lassen es 2h bei Raumtemperatur stehen. JACS 94, 6164(1972) empfiehlt 2h bei -10 Grad Celsius, dann eine halbe Stunde bei Raumtemperatur ruhen und den Gebrauch von cis- statt trans-Verbenol (das Letztere zerfaellt naemlich bei Raumtemperatur). Die Reaktion laeuft auch unter Stickstoff, das Doppelte an Verbenol, das Einfache an Olivetol, 0,85ml BF3-aetherat und 85ml Methylenchlorid/g Verbenol (beides frisch destilliert ueber Calciumhydrid) sind noetig, um 50% Ausbeute zu erhalten.
Die Quelle JACS 94, 6159(1972) erwaehnt den Gebrauch von Citral und Arzneim. Forsch. 22, 1995(1972) den Gebrauch von p-TSA. In der Synthese von THC mit Verbenol ist das cis-Isomer gegenueber dem trans-Isomer zu bevorzugen, da sich das Letztere bei Zimmertemperatur zersetzt. Pinen oder Carvon geben wirksame THC-Analoge. (#23/15f.)
1M (+)-trans-2-Carenoxid (2-Epoxycaren), 1M Olivetol oder ein Analog und 0,05M p-Toluolsulfonsaeure werden in 10l Benzol gegeben. Es wird 2h lang am Rueckfluss gekocht. Anschliessend wird im Vakuum verdunstet, (Das unverbrauchte Olivetol kann auch wie oben beschrieben abgetrennt werden.) um 30% Ausbeute n THC zu erhalten. 3-Carenoxid ergibt 20% Ausbeute fuer delta-1(6)THC. (#23/16)
1g CBD (Cannabidiol) und 60mg p-Toluolsulfonsaeure (oder 0,003M Trifluoressigsaeure) in 50ml Benzol werden 1,5h lang am Rueckfluss erhitzt. Es wird im Vakuum verdampft, um rund 0,7g THC zu erhalten. (#23/16)
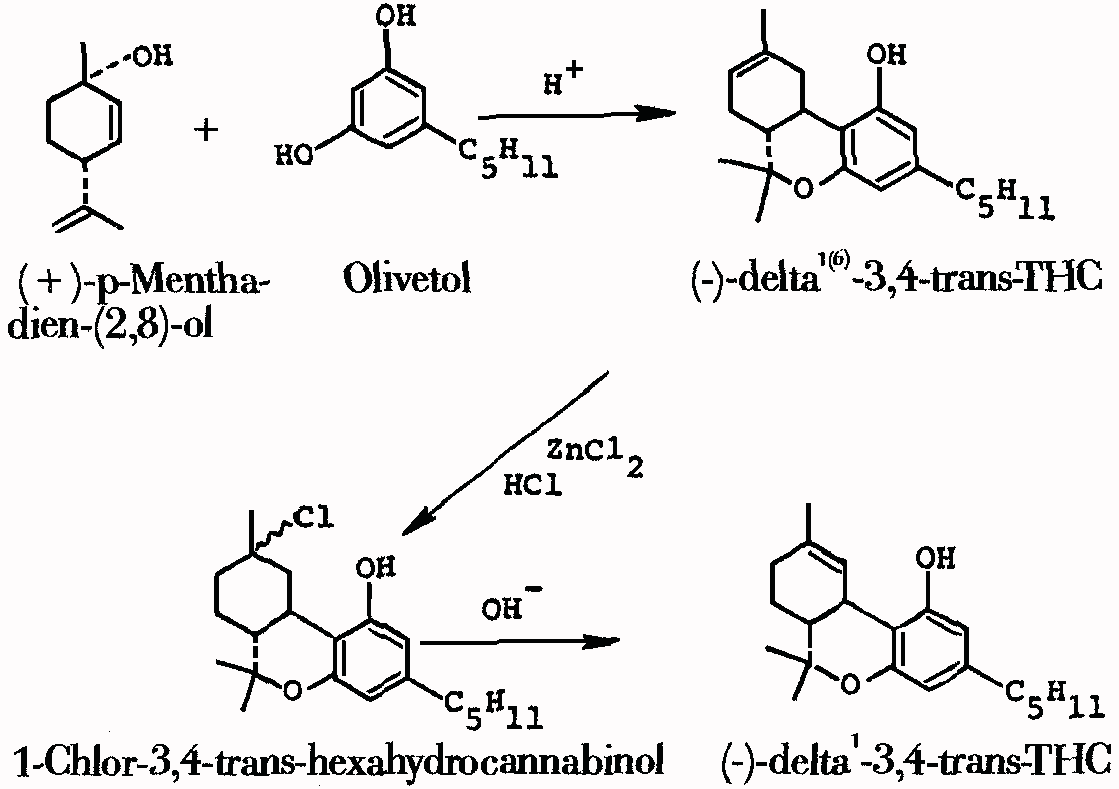 Abb. Syntheseschema von (-)-delta1-3,4-trans-THC.
Abb. Syntheseschema von (-)-delta1-3,4-trans-THC.
Die Dosis betraegt 0,25mg/kg. Sie wurde von R. Mechoulam bestimmt. (#62/452)
1966: Isolation aus Cannabis spp. durch Hively. (#62/452)
1967: Synthese des Isomers delta6-THC durch R. Mechoulam. (#62/452)
Abbildung 1: In: TRACHSEL Daniel, RICHARD Nicolas: "Psychedelische Chemie.", S. 376f., Nachtschatten Verlag, Solothurn, 2000.