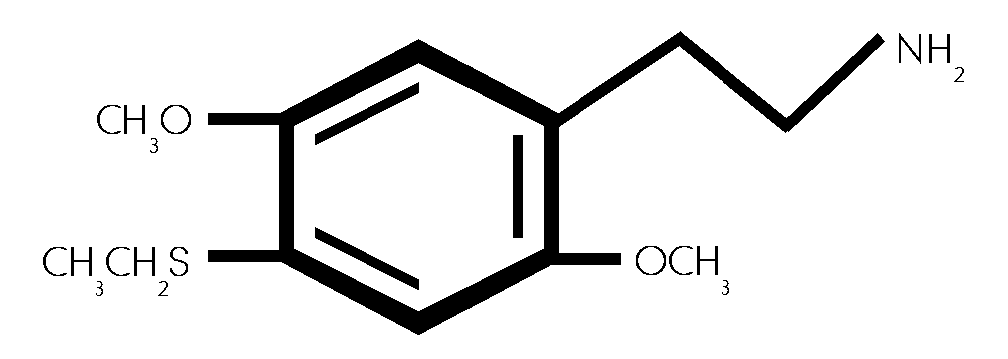

(#42/557)
2,5-Dimethoxy -4- ethylthiophenethylamin. (#42/557)
2C-T-2 ist chemisch betrachtet ein Phenethylamin. Es ist damit nahe mit einer Reihe anderer Halluzinogene verwandt, die ebenfalls Phenethylamine sind. Es waeren beispielsweise 2C-B, 2C-E, oder auch 2C-I zu nennen. Von den genannten Phenethylaminen unterscheidet sich 2C-T-2 nur durch den Substituenten an der 4. Position des Molekuels. Bei 2C-T-2 befindet sich an dieser Stelle eine Ethylthiogruppe, d.h. eine Gruppe, die auch ein Schwefelatom enthaelt. Derzeit sind noch keine natuerlichen Halluzinogene mit einem Schwefelatom bekannt. Die Veraenderungen, die sich ergeben, wenn man ein Schwefelatom in ein Phenethylamin einbaut, hat der amerikanische Drogenforscher und -designer Alexander Shulgin in seinem Werk: "PIHKAL. A chemical Lovestory." zusammengefasst. A. Shulgin hat festgestellt, dass es auch psychoaktive Verbindungen gibt, die Schwefel enthalten. Diese Verbindung ist nur ein Beispiel davon, andere waeren 2C-T, 2C-T-7,... (eigen)
A. Shulgin fuehrt in seinem Buch "PIHKAL" noch folgende Kommentare an:
Es gibt eine betraechtliche Parallele zwischen 2C-T-2 und 2C-T-7, und beide haben sich als ausgezeichnete Werkzeuge fuer die Introspektion erwiesen. Die Unterschiede sind groesstenteils physisch. Mit 2C-T-2 gibt es mehr Neigung zu koerperlichen Stoerungen, wie Uebelkeit und Durchfall. Und die Erfahrung ist klar kuerzer. Mit 2C-T-7 sind koerperliche Stoerungen seltener, aber man ist fast doppelt so lange von der Wirkung betroffen. Beide wurden haeufig in der Therapie benutzt, nach der Verabreichung von einer Dosis MDMA. (#42/560f.)
A. Shulgin gibt in seinem Werk "PIHKAL" folgende Wirkungsbeschreibungen an:
20mg: Ich waehlte 2C-T-2 mit dieser Dosis wegen des spaeten Beginns, und ich wollte eine kuerzere Erfahrung mit meiner Tochter und ihrer Familie haben. Ich fuehlte, wieauchimmer, dass ich ein wenig Koerperbelastung mit 2C-T-7 habe. Heute brauchte ich die Hilfe, die moeglicherweise von diesem Material kommt, und es war heute mein Verbuendeter. Ich brauchte dringend diesen Typ von Hilfe, den es leistet. Das Ergebnis war, die schweren Gefuehle von Muedigkeit und Mangel an Motivation abzubauen, die mich verfolgten. Am naechsten Tag fuehlte ich, dass meine Buerde weggefallen war. (#42/559f.)
20mg: Es gibt eine Neutralitaet zu dieser Droge. Ich bin am Maximum, und ich frage mich selbst, 'Geniesse ich es?' und die Antwort ist, 'Nein, ich erfahre es'. Genuss scheint nebensaechlich zu sein. Es ist ein ziemlich intensives tatsaechliches +3. Ist es interessant? Ja, aber hauptsaechlich in Erwartung weiterer Entwicklungen. Ist es inspirierend? Nein. Ist es negativ? Nein. Bin ich froh es genommen zu haben? Ja. Nicht froh. Befriedigt und zufriedengestellt. Dies ist ein kontrolliertes +3. Keine Bedrohung. Der Koerper ist in Ordnung. Nicht praechtig gesund, aber OK. Es ist nicht von Interesse. Wenn ich den Koerperzustand definieren sollte, wuerde ich ihn als Bild definieren muessen. Das Bild ist ein nicht bequemer Status des Zusammengepresstseins. Zusammengepresst? Gut, vorsichtig in Kontrolle eingebunden. (#42/559f.)
22mg: Es gab ein langsames Einsetzen. Es dauerte 1h bis zu einem +, und beinahe noch 2h, um ein 3+ zu erreichen. Sehr lebendige Phantasiebilder, mit geschlossenen Augen, aber kein Verwischen der Linien zwischen 'Realitaet' und Phantasie. Einige gelbgraue Muster wie bei Psilocybin. Akuter Durchfall nach der 4. Stunde, aber keine anderen offensichtlichen physischen Probleme. Die Erotik ist lieblich. Gutes Material fuer eine unbekannte Zahl an moeglichen Anwendungen. Kann fuer eine lange Zeit erforscht werden. Ich werde das naechste mal besser 20mg probieren. (#42/559f.)
25mg: Ich war auf einem 3+ in 1h! Es ist schon sehr schwierig gewoehnliche Dinge zu tun. Ich schrieb Kommentare, aber nun kann ich sie nicht mehr finden. Ich bin viel zu high fuer irgendetwas Kreatives, wie das Betrachten von Bildern oder Lesen. Das Reden ist OK. Und zu meiner Ueberraschung war ich in der Lage schlafen zu gehen, und es gab guten Schlaf nach der 7. Stunde. (#42/559f.)
A. Shulgin gibt in seinem Buch "PIHKAL" den Dosisbereich mit 12-25mg an. (#42/559)
Die Dauer der Wirkung betraegt nach A. Shulgin´s Werk "PIHKAL" 6-8h. (#42/559)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
Die Synthese dieser halluzinogenen Rauschdroge wird von A. Shulgin in seinem Werk "PIHKAL" folgendermassen angegeben:
Zu einer Loesung von 165g 1,4-Dimethoxybenzol in 1l CH2Cl2, an einem sehr gut beluefteten Ort durchgefuehrt und kraeftig geruehrt, wurden vorsichtig 300ml Chlorsulfonsaeure hinzugefuegt. Als rund die Haelfte des Saeurechlorids zugefuegt war, gab es eine kraeftige Bildung von HCl Gas und die Bildung von einer Menge an Feststoffen. Als die Zugabe fortgesetzt wurde, loesten sich diese wieder, um eine klare, dunkelgruene Loesung zu bilden. Gegen Ende der Zufuegung bildeten sich wieder einige Feststoffe. Als alles stabil war, wurden 2l H2O hinzugefuegt, wenige ml gleichzeitig, im Einklang mit der Energie der Reaktion. Die zwei Phasen wurden getrennt, und die waessrige Phase mit 2x75ml CH2Cl2 extrahiert. Die originale, organische Phase und die Extrakte wurden zusammengefuegt. Das Loesungsmittel wurde im Vakuum entfernt. Der Rest wog 162g und war voelig reines 2,5-Dimethoxybenzolsulfonylchlorid, ein gelber, kristalliner Feststoff mit einem mp von 115-117 Grad Celsius. Es brauchte fuer den naechsten Schritt nicht weiter gereinigt werden. Es scheint stabil beim Lagern zu sein. Das Sulfonamid, von diesem Saeurechlorid und Ammoniumhydroxid, ergab weisse Kristalle aus EtOH, mit einem mp von 147.5-148.5 Grad Celsius.
Die folgende Reaktion ist eine sehr kraeftige und muss in einem gut beluefteten Platz durchgefuehrt werden. Zu einer Loesung von 400ml 25%-iger H2SO4 (V/V), in einem Becherglas mit mindestens 2l Groesse, wurden 54g 2,5-Dimethoxybenzolsulfonylchlorid hinzugefuegt. Die Mischung wurde am Dampfbad erhitzt. Die gelben Kristalle des Saeurechlorids schwammen auf der Oberflaeche der waessrigen Schicht. Man sollte 80g Zinkstaub bei der Hand haben. Eine kleine Menge Zn-staub wurde auf einen Punkt der Oberflaeche platziert. Unter gelegentlichen Ruehren mit einem Glasstab wurde der Temperatur erlaubt zu steigen. Bei rund 60 oder 70 Grad Celsius ergab sich eine exotherme Reaktion auf dem Flecken, wo das Zink" platziert war. Zusaetzliche Zinkstueckchen wurden hinzugefuegt. Jeder kleine, exotherme Reaktionsplatz wurde mit dem Glasruehrstab verteilt. Schliesslich verteilte sich die Reaktion auf die ganze feste Oberflaechenschicht, unter Schmelzen des Saeurechlorids und sichtbaren Kochen auf der H2O Oberflaeche. Der Rest von den 80g Zinkstaub wurde hinzugefuegt, so schnell, wie die Groesse des Reaktionskolben es erlaubt. Nachdem die Dinge sich wieder gesenkt hatten, wurde das Erhitzen fuer 1h am Dampfbad fortgesetzt. Nachdem die Reaktionsmischung auf Raumtemperatur abgekuehlt war, wurde sie durch Papier in einem Buechner-Trichter filtriert. Das restliche Metall wurde mit 100ml CH2Cl2 gewaschen. Das 2-Phasen Filtrat wurde getrennt. Die untere, waessrige Phase wurde mit 2x75ml CH2Cl2 extrahiert. Die Zugabe von 2l H2O zur waessrigen Phase machte diese zur oberen Phase in der Extraktion. Dies wurde nocheinmal mit 2x75ml CH2Cl2 extrahiert. Die organischen Extrakte wurden vereint (H2O Waschen ist zu problematisch, als dass es sinnvoll waere). Das Loesungsmittel wurde im Vakuum entfernt. Der leicht bernsteinfarbene Rest (30g) wurde bei 70-80 Grad Celsius mit einem Druck von 0.3mm/Hg destilliert, um 25.3g 2,5-Dimethoxythiophenol, als weisses Oel, zu ergeben.
Zu einer Loesung von 3.4g KOH-Plaetzchen in 75ml kochendem EtOH wurde eine Loesung von 10g 2,5-Dimethoxythiophenol in 60ml EtOH hinzugefuegt, gefolgt von 10.9g Ethylbromid. Die Reaktion war exotherm mit der unmittelbaren Ablagerung von weissen Feststoffen. Dies wurde am Dampfbad 1.5h erhitzt, zu 1l H2O hinzugefuegt, mit HCl angesaeuert, und mit 3x100ml CH2Cl2 extrahiert. Die vereinten Extrakte wurden mit 100ml 5%-iger NaOH gewaschen, und das Loesungsmittel im Vakuum entfernt. Der Rest war 2,5-Dimethoxyphenylethylsulfid, dass ein blass bernsteinfarbenes Oel war, dass rund 10g wog und dass ausreichend rein war fuer den Gebrauch im naechsten Reaktionsschritt.
Eine Mischung von 19.2g POCl3 und 18g N-Methylformanilid wurde kurz am Dampfbad erhitzt. Zu dieser weinroten Loesung wurde das obige 2,5-Dimethoxyphenylethylsulfid hinzugefuegt. Die Mischung wurde am Dampfbad zusaetzliche 20 Min. erhitzt. Dies wurde dann zu 500ml kraeftig geruehrtem, warmen H2O (vorgewaermt auf 55 Grad Celsius) hinzugefuegt. Das Ruehren wurde fuer 1.5h fortgesetzt, in dieser Zeit hatte sich die oelige Phase komplett zu einer braunen zuckerartigen Konsistenz verfestigt. Die Feststoffe wurden durch Filtration entfernt, und mit zusaetzlichem H2O gewaschen. Nachdem abgesaugt worden war, so trocken wie nur moeglich, wurden diese Feststoffe in 50ml kochendem MeOH geloest, was nach dem Abkuehlen in einem Eisbad, beinahe-weisse Kristalle aus 2,5-Dimethoxy-4-(ethylthio) benzaldehyd ergab. Nach Filtration, massvollem Waschen mit kaltem MeOH und Lufttrocknen zu konstantem Gewicht, wurden 11g Produkt, mit einem mp von 86-88 Grad Celsius, erhalten. Umkristallisieren von einem kleinen Beispiel neuerlich aus MeOH ergab ein analytisches Beispiel mit dem mp 87-88 Grad Celsius.
Zu einer Loesung von 11g 2,5-Dimethoxy-4-(ethylthio) benzaldehyd in 100g Nitromethan wurden 0.5g wasserfreies Ammoniumacetat hinzugefuegt. Die Mischung wurde am Dampfbad 80 Min. lang erhitzt (dieser Reaktionfortschritt muss durch TLC ueberwacht werden, um einen Punkt festzulegen, an dem das startende Aldehyd verbraucht worden ist) Das ueberschuessige Nitromethan wurde im Vakuum entfernt, was einen Rest zurueckliess, der ploetzlich orangerote Kristalle bildete. Diese wurden herausgekratzt, um 12.9g rohes 2,5-Dimethoxy-4-ethylthio-beta-nitrostyren, mit einem mp von 152-154 Grad Celsius, zu ergeben. Ein Beispiel wurde aus Toluol umkristallisiert, war kuerbisfarben und hatte einen mp von 148-149 Grad Celsius. Ein anderes Beispiel aus Aceton schmolz bei genau 149 Grad Celsius, und war leicht orange. Aus IPA entstanden aufsehenerregende fluoreszierende, orange Kristalle, mit einem mp von 151-152 Grad Celsius.
Eine Suspension von 12.4g LAH in 500ml wasserfreiem THF wurde unter He geruehrt. Zu dem wurden 12.4g 2,5-Dimethoxy-4-ethylthio-beta-nitrostyren in wenig THF hinzugefuegt. Die Mischung wurde kochend am Rueckfluss gehalten fuer 24h. Nachdem die Reaktionsmischung auf Raumtemperatur abgekuehlt war, wurde das ueberschuessige Hydrid durch die vorsichtige Zugabe von 60ml IPA zerstoert, gefolgt von 20ml 5%-iger NaOH, wiederum gefolgt, von genug H2O, um den Oxyden einen weissen, koernigen Charakter zu verleihen. Die Reaktionsmischung wurde filtriert. Der Filterkuchen wurde zuerst mit THF und dann mit MeOH gewaschen. Das Entfernen der Loesungsmittel von den vereinten Filtraten und Waschungen im Vakuum ergab 9.5g gelbes Oel. Dies wurde zu 1l verd. HCl hinzugefuegt und mit 2x100ml CH2Cl2 gewaschen, was die Farbe entfernte. Nachdem die waessrige Phase mit 25%-iger NaOH basisch gemacht wurde, wurde sie mit 3x100ml CH2Cl2 extrahiert, die Extrakte vereint, und die Loesungsmittel im Vakuum entfernt, um 7.3g blass bernsteinfarbenes Oel zu erhalten. Destillieren bei 120-130 Grad Celsius mit einem Druck von 0.3mm/Hg ergab 6.17g klares, weisses Oel. Dies wurde in 80ml IPA geloest und mit konz. HCl neutralisiert, was sofort Kristalle aus 2C-T-2-HCl bildete. Die gleiche Menge an wasserfreiem Et2O wurde hinzugefuegt. Nach gruendlichen Mahlen und Mischen, wurde das Salz durch Filtration entfernt, mit Et2O gewaschen, und bis zu einem konstanten Gewicht luftgetrocknet. Die resultierenden, weissen Kristalle wogen 6.2g. (#42/557ff.)
1981: Die Droge wird erstmals von A. Shulgin synthetisiert. (EBDD)
2000: Im November wird ein Fall von Handel mit 2C-T-2 berichtet. (EBDD)
2006: Die Droge wird unter das Einheitsuebereinkommen (single convention) der UN gestellt. Damit ist sie beinahe weltweit verboten. (#134)
Abbildung 1: In: TRACHSEL Daniel, RICHARD Nicolas: "Psychedelische Chemie.", S. 335, Nachtschatten Verlag, Solothurn, 2000.