
(#42/574)
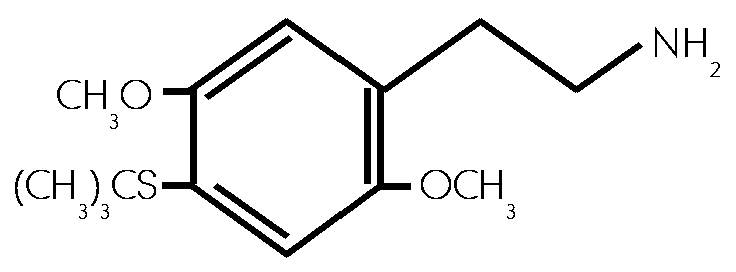
2,5-Dimethoxy -4-(t)- butylthiophenethylamin. (#42/573)
Das Halluzinogen 2C-T-9 ist chemisch betrachtet ein Phenethylamin und damit sehr nahe verwandt mit anderen, halluzinogenen Phenethylaminen, wie 2C-B, 2C-I oder 2C-C. Von diesen Verbindungen unterscheidet es sich nur durch den Substituenten an der 4. Position. Bei 2C-T-9 befindet sich an dieser Stelle eine (t)-Butylthiogruppe, d.h. eine Molekuelgruppe, die ausserdem sogar noch ein Schwefelatom enthaelt. Halluzinogene mit einem Schwefelatom kommen natuerlich nicht vor. Diese schwefelhaeltigen Verbindungen wurden von dem amerikanischen Drogenforscher und -designer A. Shulgin untersucht, wobei dieser feststellte, dass eben auch Halluzinogene gibt, die ein Schwefelatom enthalten. Beispiele fuer diese Gruppe waeren: 2C-T2, 2C-T7, 2C-T9, um nur einige zu nennen. Shulgin hat die Ergebnisse dieser Untersuchungen in seinem Werk "PIHKAL" festgehalten, dass in den letzten Jahren zum Standardwerk ueber halluzinogene Phenethylamine und Amphetamine geworden ist. (eigen)
A. und A. Shulgin geben in ihrem Buch "PiHKAL: A Chemical Love Story" folgende Erlebnisberichte an:
90mg: 2C-T-9 schmeckt wie altes Getriebeoel. Ich war auf etwas um ein ++ in der 3.h. Obwohl nichts Visuelles bemerkt wurde, wuerde ich sicherlich nicht fahren. Irgendwie wirkt dies mehr auf den Koerper als auf den Kopf. Ich fuehle, dass die Wirkungen ungefaehr in der sechsten Stunde abnehmen, aber es gibt eine sehr starke Koerpererinnerung, die das Schlafen schwierig macht. Schliesslich, etwas nach Mitternacht und mit der Hilfe von einem Glas Wein, etwas Schlaf. (#42/575f.)
125mg: Es gab ein stetiges Steigen zu einem 3+ in den ersten paar Stunden. So weit, der Koerper war sehr friedvoll ohne irgendeinen starken Energieschub oder Magenprobleme, obwohl mein Bauch darauf bestand mit ausgepraegten Respekt behandelt zu werden, vielleicht aus Gewohnheit, vielleicht auch nicht. In der fuenften Stunde ist die Koerperenergie ziemlich stark, und ich habe die Wahl sie in etwas Aktivitaet zu konzentrieren, wie Liebemachen oder Schreiben, oder mich mit Zehentappen und Herumwandern zu beschaeftigen. Fuer einen Novizen wuerde dies eine moerderisch schwierige Erfahrung sein. Zu viel Energie, zu langwirkend. Ich vermute, dass ich mich daran gewoehnen koennte, aber ich moechte mich entscheiden, wenn ich schlafen gehe, genauer, was es fuer eine Art von Schlaf ist. Es stellte sich heraus, dass das Schlafen OK war, aber fuer die naechsten paar Tage gab es ein fortgesetztes Bewusstsein von etwas Restlichem im Koerper, eine Art nieder dosierter Vergiftung. Ich fuehle allgemein, dass es keine damit verbundene Aufregung oder Kreativitaet gibt, sicherlich nicht genug um die Kosten fuer den Koeper zu rechtfertigen. (#42/575f.)
Der Dosisbereich umfasst 60-100mg Substanz, wie A. Shulgin in seinem Buch "PIHKAL" festgestellt hat. (#42/575)
Die Wirkdauer der Substanz betraegt 12-18h nach A. Shulgin´s Werk "PIHKAL". (#42/575)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt. (eigen)
A. Shulgin fuehrt folgendes Herstellungsverfahren in seinem Buch "PIHKAL" an:
Zu einer gut geruehrten, eiskalten Suspension von 2.8g p-Dimethoxybenzol und 3.2ml N,N,N',N'-Tetramethylethylendiamin in 100ml Petrolaether, unter einer Inertatmosphaere aus He, wurden 13ml einer 1.6N Loesung von Butyllithium in Hexan hinzugefuegt. Das suspendierte Dimethoxybenzol wurde undurchsichtig. Es bildete sich eine blass gelbe Farbe. Die Reaktionsmischung wurde auf Zimmertemperatur erwaermt, was sie in hellweisse Feststoffe wandelte. Nach einer zusaetzlichen 0,5h Ruehren wurden langsam 3.6g di-(t)-Butyldisulfid hinzugefuegt. Die gelbe Farbe wurde dunkler. Die Feststoffe loesten sich. Nach 1h war die Farbe ein klares dunkelbraun. Diese Loesung wurde in 100ml verd. HCl gegossen. Die organische Phase wurde abgetrennt. Die waessrige Fraktion wurde mit 3x75ml CH2Cl2 extrahiert. Die vereinten organischen Phasen wurden mit verd., waessriger NaOH gewaschen, dann mit H2O, und danach vom Loesungsmittel im Vakuum befreit. Der Rest wurde bei 95-105 Grad Celsius mit einem Druck von 0.5mm/Hg destilliert, um 3.7g 2,5-Dimethoxyphenyl-(t)-butylsulfid, als weisse, mobile Fluessigkeit, zu erhalten.
Es wurde ein festes Derivat gefunden, das Nitrierungsprodukt 2,5-Dimethoxy -4-(t)- butylthio -1- nitrobenzol, dass durch die Addition von 0.11ml konz. HNO3 zu einer Loesung von 0.23g des obigen Sulfids in 5ml eiskalter Essigsaeure erzeugt wurde. Das Verduennen mit H2O ergab gelbe Feststoffe, die einen mp von 92-93 Grad Celsius hatten, nach Umkristallisieren aus MeOH.
Eine Mischung von 72g POCl3 und 67g N-Methylformanilid wurde 10 Min. am Dampfbad erhitzt. Zu dieser weinroten Loesung wurden 28g 2,5-Dimethoxyphenyl -(t)-butylsulfid hinzugefuegt. Die Mischung wurde 10 Min. am Dampfbad erhitzt. Dies wurde dann zu 1l H2O hinzugefuegt und uebernacht geruehrt. Das restliche braune Oel wurde vom Wasser mechanisch getrennt, und mit 150ml kochendem Hexan versetzt. Die Hexanloesung wurde von unloeslichen Teeren dekantiert. Beim Kuehlen lagerte sich dunkles Oel ab, welches nicht kristallisierte. Das verbliebene Hexan wurde im Vakuum entfernt. Der Rest wurde mit dem obigen in Hexan-unloeslichen dunklen Oel vereint. Alles wurde bei 0.2mm/Hg destilliert. Eine fruehe Fraktion (70-110 Grad Celsius) war hauptsaechlich N-Methylformanilid und wurde verworfen. Rohes 2,5-Dimethoxy -4- (t-butylthio) benzaldehyd ging bei 120-130 Grad Celsius ueber und wog 12g. Dies wurde nie zufriedenstellend kristallisiert, trotz der erfolgreichen Samenbildung. Es war eine komplizierte Mischung, festgestellt durch TLC, die 7 verschiedene Komponenten beinhaltete. Es wurde fuer den naechsten Schritt, als roh destillierte Fraktion, gebraucht. Zu einer Loesung von 10g unreinen 2,5-Dimethoxy- (t-butylthio) benzaldehyd in 75ml Nitromethan wurde 1g wasserfreies Ammoniumacetat hinzugefuegt. Die Mischung wurde am Dampfbad 1.5h lang erhitzt. Entfernen der ueberschuessigen Loesungsmittels/Reagentien unter Vakuum erzeugte ein oranges Oel, dass kompliziert war (nicht ueberraschend), festgestellt durch TLC, und dass nicht kristallisieren wuerde. Eine heisse Hexanloesung von diesem Oel liess man langsam abkuehlen und einige Tage lang bei Zimmertemperatur stehen, was eine Mischung von gelben Kristallen und einem braunen, viskosen Sirup ergab. Die Feststoffe wurden abgetrennt und aus 40ml MeOH umkristallisiert, um 3.7g 2,5-Dimethoxy -4-(t)- butylthio -beta- nitrostyren, als feine, zitronengelbe Kristalle, mit einem mp von 93-94 Grad Celsius, zu ergeben. Eine 2. Ausbeute von 1.4g hatte einen mp von 91-92 Grad Celsius.
Eine Loesung von LAH (70ml einer 1M Loesung in THF) wurde, unter He, auf 0 Grad Celsius mit einem aeusseren Eisbad abgekuehlt. Unter gutem Ruehren wurden 2.1ml 100%-ige H2SO4 tropfenweise hinzugefuegt, verteilt auf 20 Min. Dies wurde von der Addition von 4.7g 2,5-Dimethoxy -4-(t)- butylthio -beta- nitrostyren in 20ml wasserfreien THF gefolgt. Es gab einen sofortigen Farbverlust. Nach wenigen Min. weiteren Ruehrens, wurde die Mischung auf Zimmertemperatur abgekuehlt. Das Ruehren wurde 5h fortgesetzt. Das ueberschuessige Hydrid wurde durch die vorsichtige Zugabe von 10ml IPA zerstoert, gefolgt von 6ml 15%-iger NaOH und schliesslich 6ml H2O. Die lockeren, weissen Feststoffe wurden durch Filtration entfernt. Der Filterkuchen wurde mit THF gewaschen. Das Filtrat und die Waschungen wurden vereint. Nach Entfernen des Loesungsmittels im Vakuum wurden 4.66g blassgelbes Oel erhalten. Dies wurde ohne weitere Reinigung bei einem Druck von 0.2mm/Hg destilliert. Die erste Fraktion ging ueber bei 120 Grad Celsius und war ein leicht farbloses Oel, dass nicht identifiziert wurde. Das richtige Produkt destillierte bei 130-160 Grad Celsius ueber, als blass gelbes, viskoses Oel, dass 1.66g wog. Dies wurde in 10ml IPA geloest, mit 20 Tropfen konz. HCl neutralisiert und mit 80ml wasserfreiem Et2O verduennt. Nach wenigen Min. Ruhen gab es eine spontane Bildung von weissen Kristallen aus 2C-T-9, welche durch Filtration entfernt und an der Luft getrocknet wurden. Das Gewicht betrug 1.1g. (#42/573ff.)