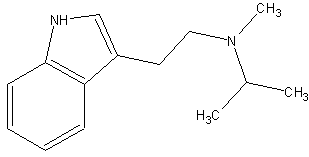

(#101/562)
Tryptamine, N-isopropyl-N-methyl; Indole, 3-[2-(isopropylmethylamino)ethyl]; N-Isopropyl-N-methyltryptamine; 3-[2-(Isopropylmethylamino)-ethyl]indole. (#101/562) N-Isopropyl-N-methyltryptamin (dt.); 3-[2-(Isopropylmethylamin)-ethyl]indol (dt.); (eigen)
Diese Verbindung ist von der chemischen Struktur her ein Tryptamin und damit nahe verwandt mit anderen hoechst psychoaktiv wirksamen Verbindungen, wie Psilocybin, Psilocin oder auch DMT. (eigen)
Von A. Shulgin und seiner Frau Ann stammen folgende subjektiven Beschreibungen ueber die Wirkungen von dieser Substanz:
(mit 5 mg, oral) "Vielleicht ein Hinweis nach einer Stunde. Nichts weiter. Schlief geraeuschvoll."
(mit 10 mg, oral) "Es gibt hier keine Frage, wie das aktiv ist. Ich fuehlte es gerade eine halbe Stunde nach der Einnahme, und etwas enttaeuschend, es wieder verschwinden zu sehen in den naechsten Stunden. Ein sehr gutes Gefuehl, ausgesprochen laufend."
(mit 10 mg, oral) "Definitiv aktiv, milde Spannung, trockener Mund, etwas Muskelspannungen im Nacken. Bei 75 Minuten, ausgesprochenes rollen, aber immer noch keine visuellen Wirkungen. Schliesslich sinkend. Nicht unangenehm, obwohl ein Gefuehl der Unruhe andauerte. Schwaecher werdene Schlaflosigkeit fuer 6-8 Stunden."
(mit 20 mg, oral) "Meine Handschrift ist erschossen. Es gibt beinahe keine Visuellen Bilder, so warum bin ich auf einem plus 2? Ich fuehle mich sehr alarmiert. Versuchte zu schlaften und endete beim Reden fuer eine Weile, alles in allem die Erfahrung kann am besten als "mild" beschrieben werden."
(mit 25 mg, oral) "Eine ausgesprochen aktive Dosis. Einige einsetzende Wirkungen so wie mit 10mg, aber betraechtlich mehr Erregung, zentrale Stimulation. Bei einer Stunde schienen die Wirkungen das Plateau erreicht zu haben. Erweiterung des visuellen Feldes, z.Bsp. aufgehellte Farben, klar definierte Objekte. Definitiv hoerbare Wirkungen, und ich kann jeden Sound mit klarer Definition herauspicken. Sehr "kopflastig", aber immer noch frei von visuellen Verzerrungen. Leichte Mydriasis. Als es nachlaesst, gibt es ein wenig Muskelziehen im Kiefer, aber nicht so viel wie mit MDA oder auch Psilocin." (#101/563f.)
Alexander Shulgin berichtet folgendes ueber die Substanz:
Es sieht so aus, wie wenn die Isopropylgruppe das Aminoxidaseenzym hemmen wuerde und damit verhindert, dass die Verbindung zersetzt wird und so keine orale Wirkung hat. Es hat eine ausgesprochen orale Wirkung, vermutlich durch die N-methylgruppe. Aber es gibt keine visuellen Erscheinungen, Bilder mit geschlossenen Augen und so weiter, wie mit anderen aktiven Tryptaminen. Aktiv ist diese Verbindung auf jeden Fall. (#101/563f.)
10 - 25 mg, oral; (#101/563)
3 - 4 h; (#101/563)
Es gibt keinen Bericht in der Literatur ueber eine koerperliche oder psychische Abhaengigkeit durch diese Substanz. (eigen)
A. Shulgin fuehrt in seinem Buch Tihkal folgende Synthesen fuer die Substanz an:
Eine Loesung von 3.36 g Tryptamin in 50 mL Toluol wurde vereint mit einer underen Loesung, die 5.52 g K2CO3 in 50 mL H2O beinhaltete und kraeftig bei Zimmertemperatur geruehrt wurde. Zu diesen wurde tropfenweise eine Loesung von 3.0 mL Benzylchlorformat in 20 mL Toluol hinzugefuegt. Das Ruehren wurde 15 h lang fortgesetzt, dann wurde die Reaktionea mit 200 mL EtOAc versetzt, die organische Schicht trennte sich ab, und wurde mit wasserfreiem MgSO4 getrocknet. Nach Filtration, wurde das Loesungsmittel in Vakuum entfernt, und der feste Rest wurde aus Et2O/Hexan umkristallisiert, um 5.25 g (85%) N-(Benzyloxycarbonyl)tryptamin mit einem Schmelzpunkt von 84-86 Grad Celsius. zu ergeben.
Eine Suspension von 0.76 g LAH in 50 mL wassserfreiem THF wurde unter einer Inertatmosphaere geruehrt, und mit der tropfenweisen Addition einer Loesung von 2.27 g N-(Benzyloxycarbonyl)tryptamin in 30 wasserfreiem THF versetzt. Die Reaktionsmischung wurde am Kochen am Rueckfluss 40 Min. lang gehalten, dann auf 40 Grad Celsius abgekuehlt und das ueberschuessige Hydrid durch die Addition einer 50%-igen waessrigen THF-Loesung zerstoert. Die Feststoffe wurden durch Fitration entfernt, mit THF gewaschen, die Filtrate und Waschungen wurden vereint, und das Loesungsmittel wurde im Vakuum entfernt. Der Rest war unreines N-Methyltryptamin (NMT), wie es gebraucht werden konnte ohne Reinigung im naechsten Alkylierungsschritt. Die Isolation, Reinigung und Charakterisierung von diesem Zwischenproduktamin ist beschrieben im NMT Rezept, und sehr wohl das reine NMT kann im folgenden reduktiven Alkylierungsschritt benutzt werden.
Das rohe N-Methyltryptamin, welches oben erhalten wurde (dass substitutiert werden kann mit 1.20 g reinem NMT) wurde in 50 mL Ethanol geloest, mit 1.0 mL Aceton, dann mit 0.5 g 10%-igem Pd/C versetzt, und die Reaktionsmischung wurde unter einer Wasserstoffatmosphaere bei 50 psi 15 h lang geschuettelt. Der Katalysator wurde durch Filtration durch ein Bett von Celite entfernt, die Filtrate wurden vom Loesungsmittel im Vakuum befreit, und der feste Rest aus Et2O/Hexan umkristallisiert, um 0.93 g N-Methyl-N-isopropyltryptamin (MIPT) zu ergeben, welches einen Schmelzpunkt von 82-83 Grad Celsius hatte. Von dem Benzyloxycarbonyltryptamin, betrug die Ausbeute 56%. Von dem NMT war die Ausbeute 62% der Theorie. Versuche zum Isopropylieren von NMT mit einem Ueberschuss am Isopropyliodid in Isopropanol ergab eine 51%-ige Ausbeute eines destillierten Produkts, dass nicht kristallisierte.
Eine Loesung von 0.47 g N-Isopropyltryptaminhydrochlorid in 50 mL H2O wurde mit 5%-iger waessriger NaOH basisch gemacht, und mit 3x40 mL CH2Cl2 extrahiert. Die vereinten Extrakte wurden vom Loesungsmitttel befreit und der feste Rest wurde in 25 mL IPA geloest und mit 0.35 g CH3I versetzt. Nach 3 h lang Kochen am Rueckfluss wurden 0.14 g CH3I hinzugefuegt und das Kochen am Rueckfluss wurde 6 h lang fortgesetzt. Nach Entfernen des Loesunsmittels im Vakuum, wurde der Rest zwischen verduennter Base und geteilt. Entfernen des Loesungsmittels im Vakuum ergab 0.29 g eines Oels, dass chromatographisch zeigte, dass die Loesung einer Mischung von NIPT und MIPT in einem 3:2 Verhaeltnis war. Dies wurde mit 0.35 g CH3I mit 25 mL IPA versetzt und es wurde erlaubt fuer einige Tage bei Zimmertemperatur zu ruhen. Eine kleine Quantitaet an Kristalllen trennte sich ab (N,N-Dimethyl-N-isopropyltryptammoniumiodid), welche durch Filtration entfernt wurden. Die Filtrate wurden befreit vom Loesungsmittel im Vakuum, und der Rest wurde wieder geteilt, wie oben zwischen waessriger NaOH und CH2Cl2. Nach demm Entfernen des organischen Loesungsmittels wurde der Rest (0.23 g NIPT zu MIPT Verhaeltnis 2:3) mit 0.5 g Essigsaeureanhydrid erhitzt auf dem Dampfbad 1 h lang, mit 5%-iger waessriger NaOH verduennt und 2 h lang geruehrt. Dies wurde mit 3x40 mL CH2Cl2 extrahiert, die Extrakte wurden vereint, mit 3x40 mL N H2SO4 extrahiert. Die vereinten Saeureexktrakte wurden mit NaOH basisch gemacht, wiederum mit CH2Cl2 extrahiert, dass beim Vereinen und Entfernen des Loesungsmittels im Vakuum 0.12 g eines farblosen OeLs ergab. Destillation bei einem Druck von 0.1 mm/Hg (140-150 Grad Celsius) ergab 0.06 g (eine 15% Ausbeute) von N-Isopropyl-N-methyltryptamin als ein farbloses Oel, dass ploetzlich kristallisierte. (#101/562f.)