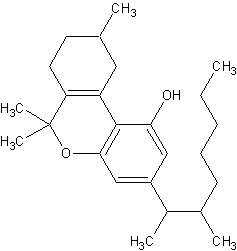

(#23/11, #54/135)
1",2"-Dimethylheptylhomolog des delta3-THC, (#23/11, #27,54/135, #61/403) Adams nine-carbon compound; (#61/403) Dimethylheptylpyran. (eigen) 1,2-dimethylheptyl-delta3THC, EA-1476; 6,6,9-trimethyl-3-(3-methyloctan-2-yl)-7,8,9,10-tetrahydrobenzo[c]chromen-1-ol; (Wikipedia)
Summenformel: C25H38O2; Mol. masse: 370.57 g/mol; Halbwertszeit: 20-39 Stunden; zaehes Oel, dass unloesbar in Wasser, aber loesbar in Alkohol oder in nicht-polaren Loesungsmitteln. (Wikipedia)
Die Verbindung ist ein synthetischer Abkoemmling des ebenso kuenstlichen delta3-THC's (Tetrahydrocannabinol). Es ist somit Abkoemmling eines Isomers des natuerlichen delta1-THC's, dass der hauptsaechliche Wirkstoff von Cannabis sativa (Hanf) ist. Isomere unterscheiden sich nicht in der Anzahl der Atome, sondern in dessen Anordnung - so ist der einzige Unterschied zwischen dem natuerlichen delta1-THC und dieser Verbindung die Lage einer Doppelbindung. Es ist logischerweise auch mit delta6-THC verwandt, welches auch natuerlich in psychoaktiven Hanfpflanzen vorkommt, denn diese Verbindung ist ebenso ein Isomer, welches sich nur in der Lage der Doppelbindung von den anderen Isomeren unterscheidet. (eigen)
Es unterscheidet sich von delta3-THC durch die 1",2"-Dimethylheptylseitengruppe, die es anstelle einer Pentylgruppe vorhanden ist. Die Dimethylheptylhomologe des THC sollen 5x so wirksam wie das natuerliche THC sein. (#23/12)
Es gibt uebrigens eine Reihe anderer Derivate von THC, bei denen die urspruengliche Pentylkette durch eine neun Kohlenstoffatom-lange Seitenkette ausgetauscht wurde. Es waeren MOP, Synthethisches "Rotes Oel" oder auch Pars Nitrogen Analog beispielsweise zu nennen. Dies sind allesamt kuenstliche Verbindungen, denn in der Natur kommen nur Ketten mit einer Methyl- (1 Kohlenstoffatom), mit einer Propyl- (3 Kohlenstoffatome) oder einer Pentylgruppe (5 Kohlenstoffatome) vor. Am haeufigsten (zu etwa 95%) werden von der Cannabispflanze Pentylgruppen erzeugt. Die beiden anderen Seitenketten kommen nur zu wenigen Prozenten, oder gar nur in Spuren im Harz der Cannabispflanze vor. (eigen)
Tauscht man die Pentylgruppe gegen eine Hexylgruppe aus, gelangt man zu den Hexylderivaten von THC, deren bekanntestes Synhexyl ist, welches einige Zeit als THC-Ersatz fuer die medizinische Forschung in Amerika zugaenglich war. Diese Verbindung ist halluzinogen wirksam. (eigen)
Es gibt ausserdem noch eine Reihe anderer, wirksamer Derivate von THC, wenn die urspruengliche Pentylgruppe, z. Bsp. durch eine Propylgruppe ersetzt wird. Dies fuehrt zu Propyl-THC (THCV), welches in manchen Haschischproben nachgewiesen wurde. Diese Verbindung ist ebenso psychoaktiv wirksam und es ist auch eine natuerliche Verbindung. (eigen)
Nach neueren Forschungsergebnissen wird die Wirkung von Cannabinoiden von den sogenannten Cannabinoidrezeptoren CB1 und CB2 im Gehirn und auch in der Milz des Menschen uebermittelt. Es gibt koerpereigene Stoffe, die sogenannten Anandamide, welche im Koerper des Menschen die Funktion von Cannabinoiden besitzen. Es wurden inzwischen 3 Anandamide nachgewiesen, welche die Wirkungen von Cannabinoiden besitzen. Es sind dies Arachidonylethanolamid, Docosatetraylethanolamid und Homo-Gamma-Linolenylethanolamid. (#100/14f.) Es soll an dieser Stelle an die entsprechenden Beschreibungen der einzelnen Anandamide verwiesen werden.
Eine THC-artige Wirkung wurde durch Untersuchungen am Menschen bestaetigt. Die Wirkstaerke von DMHP ist etwa 500x so stark wie das als Referenz verwendete, kuenstliche delta3-THC. (#61/403) Es erzeugt aehnliche Wirkungen wie THC, solche wie sedative Wirkungen, aber es ist betraechtlich potenter, speziell hat es staerkere schmerzlindernde und antikonvolsive Wirkungen wie THC, aber schwaechere psychologische wirkungen. Man nimmt an, dass es ein CB1 Agonist ist. (Wikipedia)
Die Ausbildung einer koerperlichen Abhaengigkeit ist nicht bekannt geworden. Doch aufgrund er Struktur ist mit einer psychischen Abhaengigkeit vom Cannabistyp zu rechnen. (eigen)
1949: Die sehr fruehen Untersuchungen und Arbeiten von Adams und seinen Mitarbeitern ergaben, dass die Laenge der Seitenkette am THC-Molekuel die Staerke der Wirksamkeit beeinflusse. Diese Untersuchungen von Adams wurden an Derivaten von delta3-THC durchgefuehrt. Adams entdeckte weiterhin, dass DMHP besonders stark wirksam war. (#44/80)
????: Aaron stellte alle 8 moeglichen Isomere dieser Verbindung her. (#61/403f.)
????: Pars stellte ein N-haeltiges Analog dieser Verbindung her, das sog. Pars Nitrogen Analog. (#61/404)
Siebziger Jahre: DMHP u sein O-acetatester wurden genau untersucht durch dass US Militaerchemische Waffenprogramm in Edgewood Arsenal, als moegliches nicht toedliches Knockoutmittel.
DMHP hat 3 Stereozentren und logischerweise 8 moegliche Stereoisomeree, welche betraechtlich in der Potenz variieren. Das racemische Gemisch aller 8 Isomere des O-Acetylesters bekam die Codenummer EA-2233, wobei die 8 individuellen Isomere nummeriert wurden von EA-2233-1 bis hin zu EA-2233-8. Das am meisten potente Isomer war EA-2233-2, mit einem aktiven Dosisbereich im Menschen von 0.5-2.8 mcg/kg (z.Bsp.: ca. 35-200 mcg fuer einen 70 kg Erwachsenenen). Aktive Dosen variierten zwischen den Versuchspersonen, wobei bei einer Dosis von EA-2233 mit 1-2 mg alle Freiwilligen nicht mehr in der Lage waren ihren militaerischen Pflichten nachzukommen, wobei die Wirkungen 2-3 Tage dauerten. DMHP wird metabolisiert in aehnlicher Art wie THC, was den aktiven Metaboliten 11-Hydroxy-DMHP erzeugte. (Wikipedia)