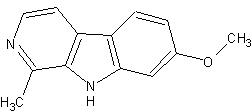

(#7, #62, #69/74, #101/455)
9-Methoxy- harman, 9-Methoxy -3- methyl -beta- carbolin, (#22) Yagein, (#12, #101/455)Leukoharmin, (#12) Banisterin, Telepathin, (#12, #36, #62, #101/455) 7-Methoxy -1- methyl -9H- pyrido[3,4-b] indol, Yaheine, yajeina, (#62) Leucoharmine (engl.), (#62, #101/455) telepatina, (#62) 1-Methyl-7-methoxy-beta-Carbolin, (#69/74) beta-Carboline, 7-methoxy (engl.); 7-Methoxy-beta-carboline (engl.), Harmine (engl.). (#101/455)
Harmine (engl.), 7-methoxy-beta-carboline (engl.). (DMT-Nexus)
Amsonia tabernaemontana
Banisteriopsis caapi, Banisteriopsis muricata, B. rusbyana;
Peganum harmala;
In kaum nennenswerten Mengen auch in den Passiflora-Arten (Passionsblumen), die vor allem als wunderschoene Zierblumen bekannt sind;
Harmin ist eine Substanz aus der Gruppe der beta-Karbolinalkaloide. (#69/74) Diese von der chemischen Struktur eindeutig abgrenzbare Gruppe zeichnet sich dadurch aus, dass eine Hemmung des Enzyms Monoaminoxidase (MAO) stattfindet. Diese Eigenschaft bei Aufnahme haben auch eine Reihe anderer Substanzen, unter anderem auch etliche Antidepressiva. Der Unterschied zwischen diesen beiden Substanzgruppen ist vor allem der, dass diese Antidepressiva eine irrevenrsible (d.h. nicht umkehrbare) Hemmung des Enzyms MAO (Monoaminoxidase) bewirken. (#17, #32, #62) Das heisst: Harmin, Harmalin, Harmalol und andere Substanzen aus dieser Gruppen hemmen dieses Enzyms nur fuer eine kurze Zeitdauer, (#62) weshalb sie als Antidepressiva eher nicht geeignet sind, da die Wirkung vermutlich nicht lange genug anhaelt; (In diesem Fall muss darauf hingewiesen werden, dass die langfristige Einnahme eines MAO-Hemmers beim Absetzen - bei einer nicht an einer depressiven Krankheit leidenden Person - zu depressiven Zustaenden fuehrt, die sich nach Tagen bis zu 1-2 Wochen legen.) (eigen)
Sehr wichtig ist diese Faehigkeit zur Hemmung der MAO durch Harmin, weil MAO-Hemmung ein Teil der funktionellen Basis fuer die trinkbaren Bereitungen ist, die am Amazonas eingenommen werden. Diese Getraenke werden mit einem Sammelbegriff als ayahuaska bezeichnet werden. Diesen trinkbaren Bereitungen ist gemein, dass sie alle einen MAO-Hemmer und das eigentlich halluzinogen wirksame Tryptamin enthalten, meist ist dies DMT, aber auch 5-Methoxy-DMT; frueher hat man lange Zeit angenommen, dass das Harmin und auch das Harmalin, die wirksamen Bestandteile der ayahuaska-Bereitungen sind, doch die eigentliche Wirkung entsteht erst durch die halluzinogenen Tryptamine! (#62)
Lange Zeit waren die Pflanzen Banisteriopsis caapi und Peganum harmala (die Steppenraute) und die daraus gewonnen Alkaloide als Halluzinogene bezeichnet worden. Heute weiss man aber, dass sie nur die notwendige MAO-Hemmung liefern, damit oral unwirksame Tryptamine ins Gehirn gelangen koennen, und dort dennoch wirksam werden. Damit wurden sie fuer die Drogenszene vieler Laender eine unersetzliche Quelle. Aber es gibt heute schon eine Reihe von anderen pharmakologischen Zubereitungen, die sich eingebuergert haben, die Jonathan Ott in seinem Werk "Ayahuasca Analogues" oder "Pharmacotheon" schon beschrieben hat. Auch die bereits oben angesprochenen Antidepressiva, medizinisch verwendete MAO-Hemmer, koennen zur Bereitung von Ayahuasca-aehnlichen Rauschdrogen verwendet werden, wie Jonathan Ott erforscht hat. Er hat diesen Mischungen an Anlehnung an das indigene ayahuaska - "Pharmahuaska" genannt. - Pharmazeutisch bereitete, halluzinogene Tryptaminbruehen. (#62)
Jonathan Ott, Autor der Buecher "Pharmacotheon" und "Ayahuasca Analogues" gibt die wirksame Dosis der Verbindung mit 2mg/kg i.v. an oder mit 8mg/kg p.o. an. (#62)
Bei Dosierungen ueber 300mg verstaerkten sich unangenehme vegetative und neurologische Symptome wie Schwindel, Uebelkeit und Ataxie, so dass sich eine Dosissteigerung ueber 750mg verbat. (#16)
A. Shulgin, Autor von "TIHKAL", gibt in diesem Werk an, dass noch keine genauen Dosisangaben bekannt sind. (#101/455)
Fp=256-257 Grad Celsius mit Zersetzung, farblose, seidenglaenzende Prismen, loeslich in EtOH, Et2O, Chloroform, wasserunloeslich, optisch inaktiv. (#12)
Schwach gelbliche Prismen aus MeOH, loeslich in MeOH, wenig in H2O, EtOH, Chloroform, Et2O; (#20)
Die Droge bildet Prismen aus MeOH mit einem mp von 261 Grad Celsius (erniedrigt). Sie ist leicht loesl. in H2O, EtOH, CHCl3 und Aether. (#62)
Freebase Harmin
Summenformel: C13H12N2O (#62, DMT-Nexus)
Mol.gewicht: 212.25 (Merck Index, Sigma Aldrich, #62)
Mol.gewicht: 212,251 Southon & Buckingham 1989.
Mol.gewicht: 212,27 (Sax & Lewis) Eintrag #HAI500; 1989.
Mol.gewicht: 212,3 Clarke's Second 1986.
Mol.gewicht: 212,55 CRC 1980-1981.
Schmelzpunkt: 262-264 °C (Sigma Aldrich, #20)
mp 253 Grad (schoene weisse Nadeln) Perrot & Raymond-Hamet 1927.
mp 256 Grad Manske 1965.
mp 257 Grad Lange Nadeln aus verd. waessrigen Ammoniak. Hasenfratz 1927
mp 257-258 Grad Telezhenetskaya 1977
mp 258 Grad Grosse Nadeln shaped. Rozenfeld 1931
mp 258 Grad Chatterjee & Ganguly 1968
mp 258-259 Grad (synthetisch) 260-261.5 Grad (von yage) Elger 1928 (Beide glaubt man, waren kontaminiert mit Harmalin)
mp 260 Grad (Korr.- etwas Zersetzung) Weisse, shiny Kristalle. O'Connell & Lynn h1953
mp 261 Grad (erniedrigt) Prismen aus Methanol. Ott 1993 (Exptl.- 262 Grad; gruenliche Kristalle aus P. harmala.)
Kristallisierte direkt aus heissem Chloroform mit concentration. Umkristallisiert von Methanol (zweimal) um Material mit mp 261.8-262.4 Grad zu ergeben. mmp mit synthetischem war nicht erniedrigt. Hochstein & Paradies 1957: Seite 5736.
mp 261 Grad (mit Zersetzung oder Sublimation) Clarke's Second 1986.
mp 263-264 Grad (aus MeOH) Bernauer 1964. (farblose Nadeln aus Aether) Elger 1928.
mp 264-265 Grad (257-259°) Southon & Buckingham 1989.
mp 266 Grad Neuss 1964.
mp 272-274 Grad Rhombische Kristalle aus Alkohol. Prismen aus Methanol. CRC 1980-1981).
Siedepunkt:
CAS Number: 442-51-3
XLogP: 2.5
XLogP3: 3.6
pKa: 7.7
Loeslichkeit:
Loeslich in alkalischen Wasser.
Loeslich in H2O.
Loeslich in Alkohol, Benzol, Chloroform und Pyridin.
Loeslich in Pyridin. CRC 1980-1981.
Leicht loeslich in Wasser, Alkohol, Chloroform, Aether. lt. Merck Index und Ott 1993.
Loeslich in Alkohol, Methanol, Chloroform und Saeuren.
Leicht loeslich in Wasser oder alkalischen Stoffen. (Ausgefaellt von Saeureloesung durch Neutralisieren mit Ammoniak) lt. O'Connell & Lynn 1953.
Loeslich in Chloroform, Aether, Methanol und verd. Schwefelsaeure: lt. Drost-Karbowska et al. 1978.
Loeslich mit Schwierigkeiten in Chloroform. Loeslich in verd. Saeuren. lt. Poethke et al. 1970.
Loeslich in Aether. lt. Hashimoto & Kawanishi. 1975
Leicht loeslich in Wasser, Ethanol, Chloroform, Aether. lt. Clarke's 1986. (#148)
Beinahe unloeslich in Wasser. Sehr sparsam loeslich in Alkohol und Aether. Sehr sparsam oder unloeslich in waessrigen Loesungen von Natriumchlorid oder Natriumnitrat. (#149)
Isolation:
Weniger wasserloeslich als Harmalin. Kristallisiert davor in der fraktionierten Kristallisation. Hasenfratz 1927. (www.erowid.org)
Um von Harmalin abzutrennen, gebrauche die pKa Eigenschaften, erhoehe den pH der Loesung die beide Alkaloide beinhaltet mit NaHCO3 auf pH 8.75, um 92% Harmin und nur 8% des Harmalin zu kristallisieren. Filtriere um die ausgefallenen Alkaloide zu erhalten, und erhoehe den pH mit NaCO3 hoeher hinauf, um die Masse des Harmalins, als zweite Kristallisierung, auszufaellen. (s. Peganum harmala).(DMT-Nexus) Noch andere Verfahren sind bei Harmalin unter Spezifikationen angegeben!
Sublimiert im Vakuum. Hochstein & Paradies 1957.
Sublimiert. CRC 1980-1981 und Merck Index.
Sublimiert im Vakuum farblose Nadeln ergebend, berichten Ghosal & Mazumdar 1971;
Waessrige Loesungen fluoreszieren blau. Hasenfratz 1927.
Salze in Loesung fluorescieren blau; nach Ansaeuerung mit Schwefelsaeure Fluoreszenz ist gruen. Elger 1928. (www.erowid.org)
Harmin Hydrochlorid
Gewoehnlich gelb. "komplett weiss" nach 2 Umkristallisierungen als Freebase; laut Hasenfratz 1927.
Lange Nadeln (unter einem Mikroskop) mp 257 Grad Celsius (von verd. waessrigen Ammoniak); Hasenfratz 1927.
Weisse Kristalle mp 261 Grad Celsius (erniedrigt) (wasserfrei- mp 319 Grad - 12.5% Cl) O'Connell & Lynn 1953. (#148)
Schmelzpunkt: 321 °C (#62, #148)
Loeslichkeit:
Loeslich in Wasser (#62, DMT-Nexus)
Unloeslich in salz-gesaettigtem Wasser.(DMT-Nexus)
Hydrochlorid dihydrat: Kristalle, mp 262 Grad Celsius (erniedrigt) [mp 321
Grad wenn wasserfrei] Merck Index und Ott 1993; (#148, #62)
mp 262 Grad Celsius; Rozenfeld 1931;
mp 264 Grad Celsius (erniedrigt) Feine Nadeln (aus Ethanol durch Zugabe von Aetherī mit HCl) Wolfes & Rumpf 1928.
Krisallisiert als Hydrochlorid von AcMe-MeOH. Ghosal & Mazumdar 1971;
Loeslich in Wasser. Ott 1993;
Loeslich in 40 Teilen Wasser, frei loeslich in heissen Wasser. Merck Index.
Unloeslich in kalten NaCl Loesungen. Hasenfratz 1927;
H2O Loesungen sind fluorescent. Rozenfeld 1931;
Waessrige Loesungen haben blaue Fluoreszens. (Merck Index).
Kristallines Material dass blaue Fluoreszens zeigte. O'Connell & Lynn 1953. (#148)
Acetat:
Wasser loeslich. Bereits konvertiert zum Hydrochlorid durch Zugabe von NaCl. Hasenfratz 1927. (#148)
Nitrat & Perchlorat: sind leicht wasserloeslich, flexible Nadeln. Wolfes & Rumpf 1928. (#148)
Harmin nitrat:
Sparsam loeslich in kaltem Wasser. Ohne weiteres loeslich in Wasser angesaeuert mit Salpetersaeure. (#149)
Harmin sulfat:
i. normal.
ii. bi. Loeslich in siedendem Alkohol. (#149)
Die Ausbildung einer koerperlichen oder psychischen Abhaengigkeit ist nicht bekannt. (eigen)
Mit reiner konzentrierter H2SO4 entsteht eine Rosafaerbung, mit unreiner eine Gruenfaerbung. (#20)
Eine Beschreibung eines Rausches, der faelschlicherweise von dem Tester Koch-Gruenberg auf die Substanz Harmin zurueckgefuehrt wurde und sich bei Wanke, Taeschner in ihrem Werk "Rauschmittel" immer noch wiederfindet, ist folgender: (Harmin alleine ist nicht wirksam, diese Beschreibung bezieht sich auf ayahuaska!): (eigen)
Huschen von roten Flammen, ein grellfarbiges Flimmern folgte. Andere erblickten schoene landschaftliche Bilder, Staedte, Lichtkreise oder bunte Schmetterlinge. (#12)
Man sieht an diesem kurzen Text, aber sehr gut, die halluzinogene Wirksamkeit von ayahuaska, deshalb wurde diese Stelle angefuehrt. Aber es hat auch Test mit der Reinsubstanz Harmin gegeben, die bis heroische Dosen gesteigert wurde, bis man endlich geglaubt hat, dass Harmin eigentlich kaum halluzinogen wirksam ist, und nicht die grundlegene, einzig wirksame Substanz in der aus der Dschungelliane Banisteriopsis caapi gewonnen Droge namens ayahuaska ist, von der man ja aus vielen Berichten wusste, dass sie aus obengenannter Banisteriopsis-Art zubereitet wird. Anbei nun ein paar zusammengefasste Beschreibungen ueber Harmin als "Halluzinogen"...:
In hohen Dosen (300-400mg p.o.) bewirkt Harmin Uebelkeit, Erbrechen, Ohrensausen, Kollapsneigung und andere unangenehme Erscheinungen. (#17) Bei Dosierungen ueber 300mg verstaerkten sich unangenehme vegetative und neurologische Symptome wie Schwindel, Uebelkeit und Ataxie, so dass sich eine Dosissteigerung ueber 750mg verbat. (#16)
C. Raetsch untersuchte ebenfalls diese Droge und gibt folgende Kommentare zu Harmin ab:
"Harmin beguenstigt das freie Assoziieren, foerdert die Phantasie und Vorstellungskraft und verstaerkt die Wirkung anderer psychotroper Substanzen (z.Bsp. von Cannabinolen und Tropanalkaloiden)." (#32)
Zu diesem Text ist noch anzumerken, dass ich mich vor einigen Jahren selbst mit der Erforschung von Harmin-haeltigen Drogen beschaeftigte und aus der Steppenraute (Peganum harmala) einen Rohextrakt bereitete, der ja die gleichen Inhaltsstoffe, wie obengenannte Banisteriopsis-Arten hat, und diesem im Selbstversuch zu mir nahm. Ich konnte ebenso kaum eine halluzinogene Wirkung feststellen, merkte aber ebenso wie C. Raetsch, dass dieser Harmin-haeltige Auszug, die Wirkung von gerauchten Haschisch verstaerkte. (eigen)
Ausfuehrliche Untersuchungen mit Harmin hat der mexikanische Ethnopharmakologe und ayahuaska-Kenner J. Ott in seinem Werk "Ayahuasca Analogues", dass sich mit dieser Droge und ihren Substituten beschaeftigt, niedergeschrieben. Aber Jonathan Ott stellte nur eine sedative Wirkung beim Testen von Harmin fest. (#62)
Aus "Dr. Duke's Phytochemical and Ethnobotanical Databases" stammt folgende Beschreibung der Wirkungen:
(Dr. Duke's Phytochemical and Ethnobotanical Databases)
Einige Kommentare, das Rauchen von Harmin und Harmin-haeltigen Pflanzen betreffend, wurden aus dem herbaltalk.com-Forum uebernommen:
Die Harmala Alkaloid RIMA Wirkungen (die MAO-A blockierenden Wirkungen, die die Wirkungen von DMT steigern) sind vielmach potenter wenn sie geraucht werden und nicht oral eingenommen! (herbaltalk.com, Ron, Re: Smoke Caapi x50 + dmt Reply #1 on: May 09, 2008, 01:35:06 PM)
Ich verstehe dass ein Caapi 50x Extrakt (aus Banisteriopsis caapi) sollte sehr gut wirken, aber wird hart zum Rauchen sein. Das DMT sollte geraucht werdenn, wenn die Wirkungen des Caapi merkbar sind. Der kombinierte trip von Rauchen der 2 wird auch viel kuerzer als ayahuasca sein, nur rund 1 h lang wirkend. Es wird eine Wirkung sehr nahe zu wahrem ayahuasca produzieren und ohne die intenisve Uebelkeit, die einige Leute mit oralen ayahuasca verspueren. (herbaltalk.com, Ron, Re: Smoke Caapi x50 + dmt Reply #1 on: May 09, 2008, 01:35:06 PM)
Reine Freebase Harmin wuerde besser arbeiten und ist einfacher zu rauchen. Aber es ist teuer. Aber es wird nicht exakt die gleichen Wirkungen wie Caapi Extrakt haben, weil Caapi beinhaltet auch Tetrahydroharmin. (herbaltalk.com, Ron, Re: Smoke Caapi x50 + dmt Reply #1 on: May 09, 2008, 01:35:06 PM)
Eine bessere Rauchkombination ist, glaub es oder nicht, Freebase Bufotenin und freebase Harmin. Es ist nicht so eigenartig wie DMT, viel mehr visuell, und wirkt viel laenger (2-3h). Der trip wird einfach akzeptiert von den meisten Leuten, weil er primaer nur eine visuelle Erfahrung ohne den Ichverlust und den anderen furchterregenden halluzinogenen Wirkungen von DMT ist. (herbaltalk.com, Ron, Re: Smoke Caapi x50 + dmt Reply #1 on: May 09, 2008, 01:35:06 PM)
1841: Goebel (Erstisolation, glaubte, dass es das einzige Alkaloid von Peganum harmala sei: er nannte es Harmalin. Es zeigte sich, dass es eine Mischung von Harmin und Harmalin war. (#148)
1847: Fritzsche: Isolation von Peganum harmala (der Steppenraute). (#148, #62)
1915: Zerda Bayon [In 1905, isolierte er einen amorphen Niederschlag, den er telepatina oder telepathine nannte.]. (#148)
1923: Fischer Cardenas isolierte, wie er meinte, eine einzelne Base. [Gebrauchte ebenso den Namen telepathine fuer die (unreine) Base, welche er isolierte.]. (#148)
1925: Barriga Villalba: Der Erste, der ein kristallines (aber unreines) Produkt von Banisteriopsis caapi isolierte; er nannte es yajeine. Es war fast reines Harmin. Er bemerkte ebenso die Gegenwart einer anderen Base in der Mutterfluessigkeit, benannte sie yagenine aber schloss keine Konstanten fuer sie ein. [Er originalerweise identifizierte sein Material als Haemadictylon amazonicum (Prestonia amazonica) [Identitaet basierte auf Reinberg] wurde aber spaeter als Banisteriopsis caapi benannt. (#148)
1925: Albarracin [Isolierte yageina und yajenina von Material von [mis]identifizierter Prestonia amazonica. Ebenso publiziert in Barriga Villalba 1925a und 1925b.]. (#148)
1926: Clinquart und Michiels & Clinquart [Isolation von yageina und yajenina von Material identifiziert als Prestonia amazonica. ] (#148)
1927: Synthese durch Manske et al. (#148)
1927: Hasenfratz [von Peganum harmala Samen.] (148) Von ihm stammt die urspruengliche Extraktionsanweisung, die ich verwendet habe und faelschlicherweise Manske zugeordnet habe. (eigen)
1927: Perrot & Raymond-Hamet 1927a und 1927b [Der Erste, der reines Material von Banisteriopsis caapi isolierte. Behielt den Namen telepathine. Berichtete die Gleichheit von telepathine and yageine.] (#148)
1927: Harmin wurde zum erstenmal von R.H.F. Manske und Mitarbeitern in den Merck'schen Laboratorib um synthetisiert. Von der Liane Banisteria caapi (heute Banisteriopsis c.), in der Harmin enthalten ist, hiess es zu jener Zeit, dass sie das Auftreten vermeintlicher telepathischer oder hellseherischer Faehigkeiten bewirken koenne. (#10) Daher stammt auch der Name Telepathin fuer die Verbindung Harmin.(eigen)
Die Droge wurde frueher uebrigens medizinisch bei postenzephalitischen Zustaenden, (#12) bei Parkinsonkranken (#12, #36) und bei Paralysis agitans (Schuettellaehmung) verwendet. (#12) Heute wird die Droge medizinisch nicht mehr verwendet. (eigen)
1928-9: Lewin [Berichtet die Isolation von Banisterine von Banisteria caapi und nahm an, dass es identisch zu dem Harmin des Chemiekonzens E. Merck sei.] (#148)
1928: Elger [Zeigte, dass Harmin aus der Yage-liane identisch war mit dem von Harmin aus Peganum harmala.] (#148)
1930: Eine weitere chemische Synthese wurde durch Spaeth entwickelt. (#62)
1928: Wolf & Rumpf [Arbeiter bei Merck, die zeigten dass Harmin aus Banisteriopsis identisch war mit dem isolierten Harmin aus Peganum harmala.] (#148)
1928: Brueckl & Mussgnug 1929, Dalmer 1929, Elger 1928, Keller & Gottauf 1929 und Wolfes & Rumpf 1928 [Berichteten die Gleichheit von telepatina, yageina and banisterine]. (#148)
1930: Synthese durch Spath & Lederer 1930a und Spath & Lederer 1930b. (#148)
1930: Synthese durch Akaboro & Saito. (#148)
1931: Rozenfeld [Isolation aus Peganum harmala Wurzeln.]. (#148)
1931,39: Chen & Chen 1939 und Williams 1931 [Zeigten, dass telepathine, yageine und banisterine identisch war mit Harmin. Isolierten Harmin von Stengeln, Blaettern und Wurzeln von Banisteriopsis caapi] (#148)
1934: Synthese durch Hahn et al. (#148)
1934: Synthese durch Iyer & Robinson (von Harmalin). (#148)
1938: Synthese durch Harvey. (#62)
1938: Arispe [Berichtete die Isolation von yageina and yagenina aus Banisteriopsis caapi.] (#148)
1938: Synthese durch Hahn et al. (#148)
1938: Synthese durch Harvey & Robinson. (#148)
1951: Synthese durch Cook et al. (#148)
1953: O'Connell & Lynn [Isolierte nur Harmin von Banisteriopsis inebrians.] (#148)
1954: Mors & Zaltzman [Von beiden Banisteriopsis caapi und Cabi paraensis] (#148)
1957: Hochstein & Paradies [Dachten es sei von Banisteriopsis caapi; sie namen die Identitaet an, weil sie aktuell davor eine zubereitete Bruehe von Ayahuasca analysierten. Es wurde gesagt, sie sei aus Banisteria caapi erzeugt worden.] (#148, #62)
1965: Poisson [Isolierte Harmin von Banisteriopsis inebrians und berichtete die Praesenz von kleinen Mengen an Harmalin.] (#148)
1997: Synthese durch Shulgin & Shulgin 1997 (von Harmalin aus). (#148)
A. Shulgin gibt in seinem Werk "TIHKAL" folgendes Herstellungverfahren von Harmin aus der verwandten Verbindung Harmalin an:
Zu einer Loesung von 0,5g Harmalinhydrochlorid-dihydrat in 8ml EtOH, welche 8ml konz. HCl enthielt, wurde eine Loesung von 0,25ml konz. HNO3 in 7ml EtOH gegeben. Diese Reaktionsloesung wurde auf dem Dampfbad erhitzt, bis eine exothere Reaktion sich einspielte, mit betraechtlichen Blubbern. Das Erhitzen wurde noch 0,5 Min. fortgesetzt, dann wurde die Reaktionsmischung aber abgekuehlt, was einen Haufen fein-weisser Kristalle ergab. Die Kristalle wurden durch Filtration abgetrennt und leicht mit EtOH gewaschen. Nach dem Lufttrocknen wurden so 0,31g (67%) Harminhydrochlorid-monohydrat erhalten, welches anschliessend noch in 3,1ml H2O geloest wurde und mit wenigen Tropfen konz. NH4OH neutralisiert wurde. Es wurden feine, blass-cremefarbene Feststoffe durch Filtration abgetrennt und anschliessend an der Luft getrocknet, was 0,22g (89%) Harmin-base als weissliches Pulver ergab. MS (in m/z): Elternion 212 (100%); 169 (67%); 197 (24%). IR (in cm-1): 819, 951, 1037, 1110, 1138,1165. Harminhydrochlorid-hydrat, IR (in cm-1): 737, 800, 821, 1021, 1076, 1110, 1138, 1162. (#101/455)
"100g des Holzes der Liane Banisteriopsis caapi wurden mit 80 ccm 5%iger Sodaloesung durchgefeucht und im Soxleth-Apparat 5h lang mit Et2 extrahiert. Der aetherischen Loesung wird das Alkaloid durch Schuetteln mit 15 ccm Normalschwefelsaeure und 50 ccm H2O entzogen. Die saure Loesung wird durch Schuetteln mit etwas Entfaerbungskohle geklaert und filtriert. Dann wird das Filtrat mit Ammoniak im Ueberschuss versetzt und mit Et2O 3x ausgeschuettelt. Die aetherische Loesung wird im Scheidetrichter mit wenig H2O gewaschen, mit Natriumbicarbonat getrocknet, filtriert und mit alkoholischer HCl neutralisiert. Das abgeschiedene Hydrochlorid, das Banisterin, wird durch Ausloesen in warmen Alkohol und Faellung mit Et2O gereinigt. Es kristallisiert aus H2O in farblosen Nadeln, welche bei 260-270 Grad Celsius unter Zersetzung schmelzen. Das Chlorid und besonders das Nitrat sind in H2O, das etwas HCl bzw. Salpetersaeure enthaelt, ziemlich schwer loeslich." (#16)
Man kann das Alkaloid auch gewinnen, indem man die Droge mit 1%iger H2SO4 5mal auslaugt, die Loesungen im Vakuum auf etwa 200 ccm einengt und sie mittels Kohle klaert. Dann nimmt man nach Zusatz von Ammoniak das Alkaloid in Et2O auf und entzieht es denselben wieder durch Schuetteln mit 15 ccm Normalschwefelsaeure und 50 ccm H2O. Die Ausbeute betrug in Merck'schen Versuchen etwa O,4% des Hydrochlorid, bezogen auf lufttrockene Droge.(#16)
Es kann zusamen mit Harmalin aus den Samen der Peganum harmala (Steppenraute) mit Hilfe von verd. Essigsaeue geloest werden, die festen Teile wurden wegfiltrieret, und die entstandene Loesung wird mit kalter, konz. NaCl versetzt, um die Alkaloid auszufaellen. (eigen)